Continuo os comentários sobre a revisão publicada por Blakeley e Plotkin em maio de 2016.
Os autores começam definindo a neurofibromatose do tipo 2 (NF2) como sendo mais rara do que a NF1, pois acontece em cerca de uma em cada 25 mil a 33 mil pessoas. Esta variação na incidência da NF2 se deve às diferenças entre as maneiras como os estudos foram realizados. Da mesma forma que a NF1, a NF2 está associada a tumores múltiplos no sistema nervoso central e nos nervos periféricos que crescem ao longo do tempo causando problemas.
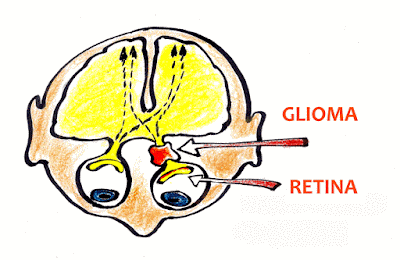
Os tumores mais comuns na NF2 são os schwannomas e os meningiomas. Os schwannomas podem ocorrer em qualquer nervo dentro ou fora do crânio, no entanto a principal característica da NF2 é a presença de schwannomas em ambos os nervos vestibulares (que levam informações posturais da orelha média para o cérebro).
Os schwannomas vestibulares bilaterais (SVB) são a principal causa de morbidade, ou seja, problemas de saúde e qualidade de vida, nas pessoas com NF2, pois levam à redução da audição até a surdez total, zumbido constante, desequilíbrio, paralisia facial e possível compressão do tronco cerebral. Esta última complicação é uma situação de urgência, pois pode resultar em morte.
Um schwannoma isolado no nervo vestibular pode ocorrer em pessoas sem NF2, geralmente mais velhas, e seu tratamento é a ressecção cirúrgica ou a radiocirurgia, especialmente para tumores menores do que 3 cm. Esta abordagem para os schwannomas isolados (sem NF2) costuma ser sugerida pelos neurologistas para o tratamento das pessoas com NF2, mas esta conduta cada vez parece a menos adequada para as pessoas com NF2.
Primeiro, porque as sequelas decorrentes do tratamento cirúrgico de múltiplos tumores na NF2 leva à maior perda de qualidade de vida, como surdez imediata, paralisia facial, dificuldade para engolir. Além disso, a radioterapia associada ao tratamento parece menos eficaz na NF2 e com maior risco de efeitos indesejáveis.
Por exemplo, O acompanhamento em longo prazo de pacientes com NF2 tratados com radioterapia para os SVB mostra que há uma chance de apenas 50% de controle do tamanho do tumor em 8 anos e de 40% de preservação da audição em 3 anos. Além disso, a radioterapia apresenta um risco de transformação maligna de outros tumores nas pessoas com NF2.
Há uma grande variabilidade nas manifestações clínicas e na gravidade da doença entre diferentes pessoas com NF2. Sabe-se que aquelas pessoas com sinais e sintomas mais precoces (na infância e começo da adolescência) apresentam prognóstico pior do que aquelas com manifestações mais tardias na vida adulta. Por outro lado, sabemos também que são menos graves as formas da NF2 em mosaico, ou seja, aquelas nas quais apenas algumas partes do corpo apresenta a mutação do gene NF2. Nas pessoas com as formas em mosaico encontramos menos tumores, sintomas mais moderados e um prognóstico geral melhor.
Seja na forma completa da NF2, seja na forma em mosaico, também existe grande variação na taxa de crescimento de cada tumor individualmente, por exemplo, é comum encontrarmos o schwannoma da orelha esquerda crescendo em ritmo diferente do schwannoma da orelha direita. Além disso, não há uma associação evidente entre o tamanho do tumor e a redução da audição.
Por tudo isto que foi dito acima, há um grande esforço científico para a compreensão da história natural da NF2, ou seja, qual é o ritmo médio dos acontecimentos, para que se possa definir o melhor momento para a intervenção terapêutica e para os critérios que devem ser adotados nas pesquisas em laboratório em busca de medicamentos eficazes. Para isso, um consórcio entre diversos centros de atendimento e pesquisa em NF2 foi reunido nos anos anteriores, construindo uma base de dados com 540 pessoas com NF2.
Uma das informações já obtidas no consórcio foi a de que a idade (média) em que é feito o diagnóstico da NF2 é em torno dos 27 anos, que ocorre uma demora de 7 anos entre os primeiros sintomas e o diagnóstico definitivo e que cerca de 30% das pessoas soreram uma cirurgia dentro de 2 anos depois do diagnóstico.
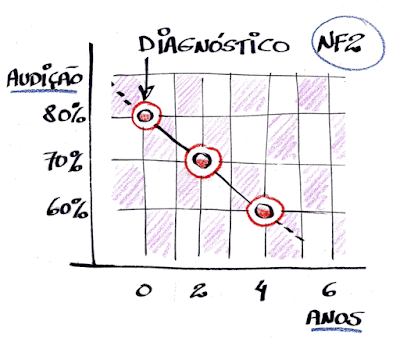
Também aprendemos que em termos médios, a taxa de crescimento anual dos schwannomas é entre 1 e 1,8 milímetros por ano, enquanto o declínio da audição é de cerca de 5% ao ano a partir do diagnóstico. Considerando-se que a progressão de um schwannoma pode ser definida quando ocorrer aumento de 20% do seu volume anterior, os dados do consórcio mostraram que em termos médios a progressão foi de 31% em um ano e 79% em três anos, enquanto a audição reduziu em 16% no mesmo período, confirmando a pouca relação entre tamanho do tumor e perda auditiva.
O estudo multicêntrico mostrou também que a maioria dos tumores (88%) não requereu qualquer cirurgia e a maioria (66%) das pessoas com NF2 mantiveram a audição de ambos os lados durante 5 anos depois do diagnóstico. Desta forma, para a maioria das pessoas com NF2, a observação clínica cuidadosa e periódica parece ser suficiente e razoável.
No entanto, para uma parte das pessoas com NF2, a doença se manifesta com crescimento progressivo dos schwannomas vestibulares bilaterais, o que acaba levando à surdez, podendo ocorrer perda da função de outros nervos cranianos, como o facial. Há estudos procurando identificar marcadores de gravidade e voltarei à eles brevemente.
Em termos gerais, apresar desta variabilidade de manifestações na NF2, as estatísticas mostram que as chances de uma pessoa com NF2 permanecer viva a partir do momento do diagnóstico são: de 85% em 5 anos, 67% em 10 anos e 38% em 20 anos. Isto resulta numa expectativa média de vida de 69 anos para as pessoas com NF2, ou seja, infelizmente, alguns anos a menos do que para a população como um todo.
Dentro de alguns dias retomarei os comentários sobre esta importante revisão recentemente publicada.