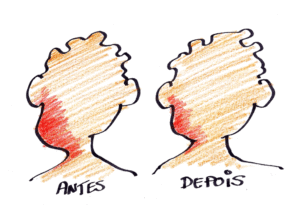
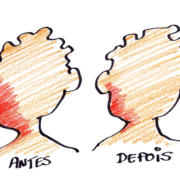
Os neurofibromas plexiformes são uma das complicações da Neurofibromatose do tipo 1 (NF1), eles já estão presentes desde o nascimento (mesmo que somente se tornem mais visíveis nos primeiros anos de vida) e ocorrem em cerca de 40% das pessoas com NF1. Em algumas pessoas eles causam deformidades importantes, especialmente quando estão na face. Além disso, os plexiformes podem não ser operáveis por causa do risco de sangramento, do local onde se encontram e dos resultados insuficientes para a correção da deformidade. Em alguns poucos casos (10 a 15%) os plexiformes, especialmente os grandes e profundos, podem apresentar transformação maligna.
Por isso, a busca por algum tratamento medicamentoso que reduza o tamanho dos neurofibromas plexiformes tem atraído a atenção de muitos cientistas em todo o mundo, como se pode ver pela a relação de estudos em andamento apoiados pela Children’s Tumor Foundation (VER AQUI).
Um dos medicamentos que vem sendo estudados é o Selumetinibe, sobre o qual já comentei aqui no início de 2017, um estudo realizado pela Dra. Eva Dombi e colaboradores, do grupo da Dra. Brigitte C Widemann, de Bethesda, nos Estados Unidos ( VER AQUI ).
Recentemente foram apresentados novos resultados do Selumetinibe em neurofibromas plexiformes pelo mesmo grupo da Dra. Brigitte C Widemann como resumo num evento científico nos Estados Unidos (VER AQUI), reforçando pesquisas anteriores que mostraram um benefício do uso do Selumetinibe para cerca de 70% das crianças com neurofibromas plexiformes em crescimento e inoperáveis. Se desejar ver fotos das crianças tratadas com o Selumetinibe naquele estudo, lembrando que são imagens fortes, entre neste link do Children’s Tumor Foundation: VER AQUI).
Para orientar os associados da AMANF, discutimos os resultados deste novo estudo no nosso grupo de médicas e médicos do Centro de Referência em Neurofibromatoses do Hospital das Clínicas da Universidade Federal de Minas Gerais (CRNF). Participaram desta discussão:
Dr. Nilton Alves de Rezende, clínico e professor de Clínica Médica da Faculdade de Medicina da UFMG e Diretor do CRNF;
Dra. Juliana Ferreira de Souza, clínica médica, com doutorado e pós-doutorado em neurofibromatose pela Faculdade de Medicina da UFMG e professora de Medicina da Família no UNIBH;
Dra. Luíza de Oliveira Rodrigues, clínica médica com mestrado em neurofibromatose pela Faculdade de Medicina da UFMG e Avaliadora de Tecnologias em Saúde da UNIMED BH;
Dr. Bruno Cesar Lage Cota, clínico com mestrado e doutorando em neurofibromatose pela Faculdade de Medicina da UFMG e médico do Hospital das Clínicas da UFMG;
Dra. Vanessa Waisberg, oftalmologista com mestrado e doutoranda em neurofibromatose pela Faculdade de Medicina da UFMG;
Dr. Luiz Oswaldo Carneiro Rodrigues (Dr. LOR), Coordenador Clínico do CRNF e presidente da AMANF (2017-2019).
Alerta
De início, é preciso lembrar que o Selumetinibe é um medicamento em fase experimental produzido pelos laboratórios farmacêuticos multinacionais Astra-Zeneca e Merck, mas que ainda não está à venda em nenhum país, conforme a Dra. Luíza de Oliveira Rodrigues conversou diretamente com representantes do Laboratório Astra-Zeneca.
Resumo dos resultados apresentados
Em resumo, o novo estudo (chamado de Fase 2) estudou 50 crianças e adolescentes com NF1 (30 meninos e 20 meninas, entre 3,5 e 17,4 anos) com neurofibromas plexiformes inoperáveis com uma ou mais morbidades decorrentes do tumor (havia dor em 28 pessoas, disfunção em 33 pessoas, deformidade em 44 pessoas).
Todas receberam Selumetinibe em ciclos contínuos de 28 dias na dose de 25 mg por metro quadrado de superfície corporal por via oral duas vezes por dia. Todas as crianças e adolescentes eram reavaliados a cada 4 ciclos (cerca de 4 meses). O número médio de ciclos reavaliados foi de 19,5.
A resposta foi considerada positiva quando ocorreu redução do tumor em mais de 20% do seu tamanho original ou redução na morbidade associada (dor, disfunção ou deformidade).
O resultado foi positivo (em geral depois de dois meses) em 36 pessoas (72%) e não fez efeito em 12 delas (24%). A redução média do volume do neurofibroma plexiforme foi de 27,7%.
Ao longo do primeiro ano de tratamento, a intensidade da dor diminuiu e a força e a mobilidade aumentaram. Foram necessários 6 meses de tratamento para que os efeitos positivos fossem observados.
Os efeitos colaterais mais frequentes foram gastrointestinais, além de creatinina aumentada sem sintomas, acne e micose nas unhas. Em 12 pessoas a dose do Selumetinibe teve que ser reduzida e 5 deles tiveram que deixar o tratamento.
A conclusão foi de que estes resultados confirmam os resultados anteriores da equipe de cientistas, que continuam a realizar novos testes em outras crianças.
Impacto do estudo
Por causa destes resultados, o Selimetinibe foi recomendado como “droga órfã” nos Estados Unidos e em países da Europa, o que torna mais fácil o seu acesso para os pacientes, mesmo que a droga ainda não faça arte das recomendações das agências reguladoras de saúde (como a FDA nos Estados Unidos e a ANVISA no Brasil). VER AQUI a recomendação
Discussão dos resultados pelo grupo do CRNF
Dr. LOR – Minha primeira impressão é de que este novo medicamento se constitui num possível tratamento para 70% dos graves casos que temos enfrentado em nosso Centro de Referência, e isto não é pouco. Creio que este estudo será um dos temas muito discutidos no próximo congresso mundial em NF do qual participaremos em novembro próximo.
Dra. Juliana – Apesar de todo o entusiasmo que estes resultados trazem para nossa comunidade NF, é preciso ressaltar que o Selumetinibe foi utilizado em crianças sem a possibilidade de tratamento cirúrgico.
Portanto, o medicamento poderá ser indicado para casos especiais e não se trata de um estudo que nos permite comparar os resultados entre a cirurgia e o tratamento medicamentoso.
Outra questão é que o fato das duas agências reguladoras (dos EUA e Europa) terem conferido um status ao Selumetinibe, no tratamento dos plexiformes que, até onde vai o meu entendimento, os aproxima da utilização mais disseminada da droga no tratamento dos plexiformes.
Existe uma chance de que acabemos por ver o efeito dominó da solicitação judicial deste tipo de tratamento por indivíduos e famílias brasileiras com recursos financeiros para acionar a justiça, já que a ANVISA está, ao meu ver, muito distante de até mesmo avaliar este tipo de tratamento para NF, aqui no Brasil.
Dra. Luíza – Da minha perspectiva como Avaliadora de Tecnologias em Saúde, vou comentar sobre a qualidade metodológica destes resultados.
- É um estudo fase II, sem comparador, nem mesmo placebo. Considerando que é uma doença rara, não é mesmo factível esperar por um ensaio clínico randomizado. Mas ainda assim, é uma limitação metodológica relevante. O estudo foi parcialmente financiado pelo fabricante do selumetinibe, AstraZeneca (disponibilidade do medicamento e fundos para análise farmacocinética).
- Este resultado citado não é de uma publicação, é de um resumo apresentado em Congresso; além de não ter sido revisado pelos pares ainda, não tenho acesso aos dados completos dessa análise, o que dificulta a interpretação correta da magnitude do efeito (especialmente em termos absolutos). VER AQUI
- O benefício (que foi de 72% deresposta parcial, definida de forma composta, como redução de 20% do tumor OU redução de sintomas) é descrito em um desfecho substituto (taxa de resposta), sem correlação com desfechos de interesse ao paciente, como qualidade de vida ou sobrevida global. O fato de ter reduzido dor em alguns pacientes não significa que melhorou a qualidade de vida, pois a toxicidade pode impactar de forma negativa na qualidade de vida (náusea, vômitos, diarreia, aumento assintomático da creatinina, acne e micoses), cujas frequências (absolutas ou relativas) não estão descritas no abstract. De forma grosseira, consegui extrair de uma tabela da publicação original (VER AQUI) que cerca de 10 (20%) dos pacientes tiveram toxicidade de grau 3 ou 4. Na tabela S4 do apêndice (VER AQUI) da publicação original podem ser conferidos os diversos eventos adversos relatados.
- Ainda quanto à toxicidade, o tratamento teve que sofrer redução de dose em 24% dos pacientes e suspensão do tratamento e outros 10%, portanto, a toxicidade é relevante, dado que 1 em 3 pacientes tem que, no mínimo, modificar dose.
- O custo do medicamento não está confiavelmente disponível, por não ter aprovação da Anvisa ainda. Dessa maneira, é difícil estimar o custo financeiro do tratamento.
Da minha perspectiva, na ausência de dados absolutos, fica difícil estimar o impacto clínico real desse tratamento. A toxicidade dos inibidores de MEK é sabidamente alta, em todos os contextos em que são utilizados. As respostas parciais, nesses casos graves (inoperáveis), ainda não foram estudadas em longo prazo. Tenho receio do tratamento ser mais vantajoso pra indústria do que para os pacientes.
Entendo que, no contexto em questão, de gravidade e sem possibilidades terapêuticas, ficamos tentados a apostar nas “esperanças”. Mas, os resultados não me são convincentes, até o momento, de benefícios reais em desfechos de interesse ao paciente, que superem os riscos. Por enquanto, me parecem resultados estatisticamente significantes em exames de imagem. Eu gostaria mais de ver resultados sobre qualidade de vida.
Aguardo a publicação completa para rever essas considerações. Quem sabe os dados absolutos demonstrem melhor algum benefício clinicamente significativo?
Dr. Bruno – Achei excelentes as análises da Luíza e da Juliana, especialmente quanto à cautela frente à relação risco e custo/benefício e ao possível e temeroso uso indiscriminado da droga por interesse da indústria farmacêutica.
A ausência da descrição pormenorizada da metodologia e dos resultados deixou muitas lacunas. Também considero importante saber se foi utilizada alguma outra medida mais global, referente à qualidade de vida, no pré e pós-tratamento.
Também ainda não existem dados sobre o efeito duradouro na redução dos tumores e da melhora dos sintomas após o término do tratamento. Embora a suspensão do Selumetinibe devido aos efeitos colaterais tenha ocorrido somente em menos de 10% dos pacientes, para 24% deles a dose da droga teve que ser reduzida, como a Luiza mencionou, e isso implicou em redução do seu efeito e retorno do crescimento do tumor – ver no relato da dra. Andrea Gross ( VER AQUI ). Se não houver um controle do crescimento do tumor e dos sintomas a ele atribuídos de forma duradoura após o término do tratamento, e consequente necessidade de reiniciar ou prolongar o uso da droga, o impacto dos efeitos adversos possivelmente será ainda maior.
Outra questão: Posso estar enganado ou até mesmo talvez já existem evidências que tornem isso desnecessário, mas um parâmetro que poderia ser interessante na avaliação do risco e custo/benefício seria a mensuração da atividade metabólica dos tumores antes do tratamento, para uma melhor indicação de quais desses teriam uma melhor resposta ao Selumetinibe. Seriam aqueles com menor atividade, com consequente menor risco de malignização, ou os de maior? Pois se forem os primeiros vejo mais um ponto desfavorável ao seu uso.
Preferi ver as imagens (das crianças tratadas) depois da nossa discussão, pois já previa que a minha opinião poderia ser influenciada por elas. E foi interessante, pois mesmo assim o impacto das imagens foi forte o suficiente para motivar a minha esperança e eu amenizar a minha crítica. Ao final disso, concluo que vejo com algum entusiasmo os resultados, mas ainda com meus dois pés bem justos ao chão.
Dra. Vanessa – Fiz uma revisão sobre os efeitos colaterais oculares dos inibidores MEK, e o Selumetinibe é relativamente seguro quando comparado aos outros quimioterápicos da mesma classe.
Os efeitos colaterais oculares do Selumetinibe relatados foram: visão turva (geralmente transitória), diplopia, edema palpebral, hemorragia subconjuntival, lacrimejamento, separação das camadas externas da retina (geralmente discreta) e descolamento do epitélio pigmentar da retina.
Efeitos colaterais graves associados a outros inibidores MEK (Trametinibe, RO5126766 e PD0325901), como oclusão de veia, uveíte, neuropatia óptica, serosa central e descolamento seroso da retina não foram associados ao uso do Selumetinibe.
Como foi dito nos comentários de Pulido e colaboradores ( VER AQUI), outro fator que pode ter ajudado na baixa taxa de efeitos colaterais oculares foi a dose mais baixa usada nas crianças do estudo.
Vale ressaltar que os pacientes que estejam em tratamento com inibidores MEK incluindo o Selumetinibe devem ter acompanhamento oftalmológico frequente.
Dr. LOR e Dr. Nilton – Agradecemos à Juliana, Luíza, Bruno e Vanessa pela discussão esclarecedora sobre este tema tão importante. Vamos levar estas nossas observações para o Congresso Mundial em Neurofibromatoses em Paris em novembro de 2018.
















 Participaram da banca examinadora os professores (na foto, da esquerda para a direita) Maria Raquel Santos Carvalho (UFMG), Juliana Ferreira de Souza (do Centro de Referência em Neurofibromatoses e do Centro Universitário UNIBH), Marcelo Rizzatti Luizon (UFMG), Wagner Carlos Santos Magalhães (do Instituto Mário Penna) e Renan Pedra de Souza (UFMG).
Participaram da banca examinadora os professores (na foto, da esquerda para a direita) Maria Raquel Santos Carvalho (UFMG), Juliana Ferreira de Souza (do Centro de Referência em Neurofibromatoses e do Centro Universitário UNIBH), Marcelo Rizzatti Luizon (UFMG), Wagner Carlos Santos Magalhães (do Instituto Mário Penna) e Renan Pedra de Souza (UFMG). Segundo, porque vi a dedicação da Cinthia com o projeto e seu desejo de continuar estudando as neurofibromatoses no seu regresso para a Universidade Federal da Bahia, dando-me a impressão de que seu contato conosco frutificará em novas pesquisas importantes. Além disso, seus orientadores e os demais professores da banca mostraram grande interesse pelo tema, sinalizando que novos alunos de pós-graduação interessados em problemas das neurofibromatoses podem surgir no campo da genética, dando continuidade a esta linha de pesquisa.
Segundo, porque vi a dedicação da Cinthia com o projeto e seu desejo de continuar estudando as neurofibromatoses no seu regresso para a Universidade Federal da Bahia, dando-me a impressão de que seu contato conosco frutificará em novas pesquisas importantes. Além disso, seus orientadores e os demais professores da banca mostraram grande interesse pelo tema, sinalizando que novos alunos de pós-graduação interessados em problemas das neurofibromatoses podem surgir no campo da genética, dando continuidade a esta linha de pesquisa.