“Gostaria de saber se o uso contínuo durante muitos anos do cetotifeno pode causar reações adversas significativas em pacientes com neurofibromatose. ” EP, de local não identificado.
Cara E., obrigado pela sua pergunta.
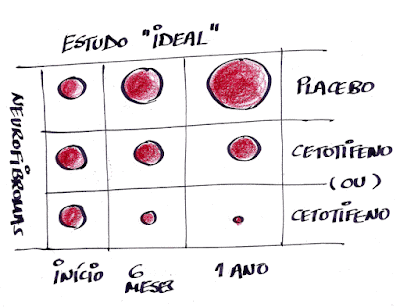
Considerando que temos indicado o cetotifeno para uso prolongado para pessoas com NF1 e com coceiras, é importante esclarecermos os possíveis efeitos colaterais do cetotifeno.
Como você sabe, no Brasil o cetotifeno é uma substância antialérgica potente porque possui propriedades bloqueadoras da histamina e é indicado na prevenção de asma brônquica, quando associada com sintomas alérgicos, para a redução da frequência e da severidade de ataques, embora não seja capaz de interromper uma crise instalada.
O cetotifeno possui poucas contraindicações, como a alergia ao próprio cetotifeno e história de convulsões (que atingem cerca de 10% das pessoas com NF1) e presença de diabetes (o que é muito raro em pessoas com NF1).
Não há contraindicação relativa a faixas etárias, mas, por outro lado há pouca experiência com o uso de cetotifeno em mulheres grávidas ou durante a lactação, o que não recomenda o seu uso nestas condições. Pode ocorrer sonolência, por isso não se recomenda dirigir veículos ou máquinas pesadas nas primeiras semanas de uso do cetotifeno. Ele também potencializa o efeito do álcool e de outros anti-histamínicos.
No entanto, o cetotifeno pode causar reações adversas em algumas pessoas, que são classificadas de acordo com a frequência de acontecimentos:
1) Muito raras, graves e que requerem atenção médica imediata (menos de 1 em cada 100 pessoas):
a. Vermelhidão da pele, bolhas nos lábios, olhos e boca acompanhando febre, calafrios, dor de cabeça, tosse e dores no corpo.
b. Pele e os olhos amarelados, fezes com coloração alterada, urina com coloração escura (sinais de icterícia, de desordens do fígado, hepatite).
2) Incomuns (ocorrem em até 1 em cada 100 pessoas):
a. Tonturas
b. Ardência ao urinar, necessidade de urinar frequentemente
c. Boca seca.
d. Sonolência
e. Peso aumentado
3) Comuns (ocorrem em até 10 em cada 100 pessoas): excitação, irritabilidade, insônia ou nervosismo.
4) Outras reações adversas podem ocorrer, mas o número de pessoas atingidas ainda não sabemos exatamente com os dados disponíveis: convulsão, dor de cabeça, sonolência, vômito, náusea, coceira na pele com vermelhidão ou diarreia.
Em caso de ingestão acidental de uma quantidade maior de cetotifeno, procure um serviço médico imediatamente. Os sintomas principais da superdose aguda incluem desde sonolência até sedação grave, confusão e desorientação, taquicardia e hipotensão (especialmente em crianças), estado de excitação mental, convulsões e coma reversível. Quando necessário procure orientação médica ou o hospital mais próximo.
Se o medicamento houver sido administrado recentemente, a equipe médica deve considerar o esvaziamento do estômago e a administração de carvão ativado. Quando necessário, recomenda-se tratamento sintomático e monitorização do sistema cardiovascular. Se ocorrerem convulsões, podem ser administrados barbitúricos de curta ação ou benzodiazepínicos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Um telefone disponível para informações sobre o cetotifeno é 0800 722 6001, se você precisar de mais orientações.