Um estudo científico bem conduzido na Austrália pelo grupo da Dra. Kathryn N. North avaliou o comportamento de crianças e adolescentes com neurofibromatose do tipo 1 (NF1), transtorno no espectro do autismo (TEA) e transtorno de déficit de atenção e hiperatividade (TDAH). (Ver aqui artigo completo em inglês) .
As equipes do CRNF e da AMANF estão preparando um texto explicativo sobre os resultados do estudo e sua aplicação prática em nossa vida. Em breve ele estará disponível em nossa página, mas quero adiantar que o estudo observou que as crianças e adolescentes com NF1, TEA e TDAH apresentam em comum comportamentos causados pelo transtorno do processamento sensorial (TPS).
O Transtorno de Processamento Sensorial são as dificuldades de uma criança para processar os diferentes estímulos que vêm do ambiente e da sociedade de forma a se comportar adequadamente naquela situação.
O que é o processamento sensorial?
O processamento sensorial é a capacidade do sistema nervoso de detectar, integrar, modular e interpretar todas as informações captadas pelos diversos sensores que foram ativados pelos estímulos que nos chegam do ambiente e do nosso próprio corpo. As informações sensoriais processadas no sistema nervoso central, que permitem nossa adaptação ao ambiente, são:
- Visuais (luz, cores, sinais, símbolos, imagens, profundidade etc.)
- Auditivas (sons, fala, música, ruídos etc.)
- Espaciais (equilíbrio, orientação espacial, posição corporal, controle motor, expressão corporal etc.)
- Táteis (textura, formato, consistência, peso e volume de objetos etc.)
- Paladar (sabores, textura, consistência de alimentos e líquidos etc.)
- Olfato (odores, aroma de alimentos, perfumes etc.)
- Térmicas (percepção da temperatura, do calor e do frio, tolerância e aclimatação)
- Dolorosas (sensibilidade, tolerância, repercussões emocionais etc.)
- Internas fisiológicas (respiração, batimentos cardíacos, fadiga, sono, movimentos intestinais, volume da bexiga etc.)
- Internas psicológicas (humor, comportamento, identidade, sentimentos, desejo sexual etc.)
A integração de todas estas informações sensoriais é que nos permite reagir adequadamente às variações internas e do ambiente. Elas são utilizadas pelo sistema nervoso para que possamos perceber de forma contínua o nosso próprio corpo num determinado ambiente físico, assim como os indicadores e regras sociais para que nosso comportamento seja adequado a cada momento em cada grupo de pessoas ou sociedade.
Em breve daremos mais informações sobre este transtorno e como podemos melhorar as pessoas com NF1 e TPS.
Dr Lor

Muitas famílias me perguntam como podem ajudar suas crianças com NF1 a superarem suas dificuldades cognitivas.
Diversas equipes de cientistas estão procurando esta resposta e temos feito grandes progressos na compreensão dos principais problemas neurológicos causados pela NF1.
Por exemplo, neste ano de 2025, Gamze Kaplan e colaboradores publicaram seu estudo sobre a interação entre os pais e a criança com NF1 e TDAH (Transtorno de Déficit de Atenção e Hiperatividade) numa revista científica (ver aqui artigo completo em inglês).
Os resultados mostraram que a NF1 e o TDAH são problemas diferentes, mas que apresentam semelhanças no curso do desenvolvimento. Os processos neuro divergentes em ambas as condições começam no primeiro ano, alterando tanto o comportamento do bebê quanto a maneira como os pais respondem a ele, porque os pais vão reduzindo as oportunidades sociocomunicativas para o desenvolvimento social do cérebro.
Este estudo comparou as interações pais-bebês em três grupos de crianças de 10 a 14 meses de idade:
- crianças com NF1
- crianças com TDAH
- crianças com desenvolvimento típico (DT)
A hipótese dos autores era de que os bebês com NF1 (Grupo 1) e bebês com TDAH (Grupo 2) mostrariam menos atenção dirigida aos seus pais e menos interação mútua entre pais e bebês, comparados aos bebês com desenvolvimento típico (Grupo 3). A suspeita era de que a atenção aos pais seria mais baixa em bebês com NF1 e que a vivacidade e o afeto negativo seriam maiores em bebês com NF1 e TDAH.
Os pais e seus bebês com NF1, TDAH e DT foram filmados durante as interações de brincadeiras livres e codificados usando escalas de classificação validadas.
Os resultados mostraram, que a interação pais-bebês dos bebês com NF1 e TDAH foram diferentes entre si e diferentes das crianças com desenvolvimento típico (DT).
O grupo NF1 mostrou relativamente menos interações mútuas (pais-bebês) do que o grupo TDAH, e respostas muito mais baixas às ações dos pais do que o grupo DT, enquanto os bebês TDAH eram mais animados e mostraram menos afetos negativos em relação aos outros grupos.
A maioria dos efeitos principais persistiu ao longo do tempo.
Embora seja necessário um acompanhamento de longo prazo em amostras maiores, estes resultados mostram como crianças com condições de neurodesenvolvimento alteradas apresentam experiências sociais distintas no primeiro ano de vida, o que pode impactar todo seu desenvolvimento cognitivo, psíquico e social ao longo da vida.
Na minha opinião, estes resultados reforçam a necessidade de que pais e cuidadores de crianças com NF1 fiquem atentos para esta baixa interação social provocada pela doença e tentem estimular estas crianças de forma planejada e consistente ao longo do seu desenvolvimento.
E a neuromodulação?
Com esta intenção em mente, algumas famílias têm perguntado se as técnicas de “neuromodulação” poderiam ser eficientes para estimular o desenvolvimento de suas crianças com NF1.
Sob o nome “neuromodulação” existem técnicas diferentes (ver anexo abaixo). Todas elas enfrentam dificuldades para padronização dos protocolos, para a quantificação de dose-resposta, e para a identificação de biomarcadores eficazes, assim como o estímulo em áreas extensas pode dificultar a localização exata dos efeitos.
E na NF1?
Até o presente, existe um grupo de pesquisadores testando a eletroestimulação transcutânea em crianças com NF1 e este grupo vem publicando seus resultados.
Em 2022, publicaram um artigo “Non-invasive brain stimulation modulates GABAergic activity in neurofibromatosis 1 — Scientific Reports (2022), com 31 adolescentes com NF1 (11–18 anos), no qual não houve melhora comportamental sustentada ao final da estimulação (desempenho durante a estimulação chegou a piorar).
Em 2025, publicaram “Non-invasive brain stimulation reorganises effective connectivity during a working memory task in individuals with NF1 — NeuroImage: Reports (2025), que não mostrou ganho cognitivo clinicamente relevante.
Finalmente, no congresso do CTF deste ano ( 2025), apresentaram um resumo que a Dra. Pollyanna Barros Batista comentou neste blog: ver aqui.
Na minha opinião, estas técnicas ainda são experimentais nas pessoas com NF1 e não há evidência de que já possam ser utilizadas como terapias efetivas.
Em conclusão, o melhor tratamento que dispomos ainda é a atenção cuidadosa de mães, pais e cuidadores para as necessidades diárias de cada criança com NF1.
Uma atenção que supere o retorno afetivo menor que as crianças com NF1 podem devolver a seus pais.
Uma atenção permanente e amorosa que procure ajudar cada uma delas a atingir seu potencial de felicidade, bem-estar e realização pessoal em sua vida.
Dr LOR
Anexo
Técnicas de neuromodulação
- Estimulação Magnética Transcraniana Repetitiva (rTMS) – Usada no tratamento de depressão resistente, TOC, e TEPT;
- Estimulação Transcraniana por Corrente Contínua (tDCS ou ETCC) – Evidências apontam benefícios em condições diversas como depressão, esquizofrenia, dependência química, além de melhora cognitiva — atenção, memória, fala pós-AVC, etc;
- Neurofeedback (NFB) – Indicado para TDAH e epilepsia, com evidência crescente para uso em autismo, insônia, ansiedade e dor de cabeça.
- Estimulação Cerebral Profunda (DBS) — técnica invasiva – Aprovada pela FDA para tratamentos como Parkinson, tremor essencial (desde meados de 1997), distonia, e algumas epilepsias em 2010. Apresenta também potencial terapêutico para depressão, TOC, demências e obesidade mórbida.
- Estimulação da Medula Espinhal (SCS) – técnica implantável, aprovada para dor crônica relacionada a cirurgia nas costas, síndromes regionais complexas e angina intratável.
Somos médicas e médicos no CRNF que acompanham centenas de famílias com Neurofibromatose do Tipo 1 (NF1), uma doença que pode causar neurofibromas. Esses tumores são geralmente benignos, mas podem trazer dor, deformidades e outras complicações. Por isso, estamos sempre em busca de tratamentos que possam controlar ou reduzir esses tumores.
Além disso, em nossa equipe no CRNF, somos 3 médicos e uma médica que têm filhas ou filhos com NF1, portanto, foi com grande interesse que lemos o estudo recente de Chen e colaboradores, publicado na revista científica The Lancet [ver aqui link para o artigo completo em inglês), que avaliou o uso do selumetinibe em adultos com neurofibromas sintomáticos que não podem ser tratados com cirurgia.
Hoje, a cirurgia é o tratamento padrão para alguns casos, mas em tumores muito grandes, espalhados ou em locais difíceis, a cirurgia não é viável. Nesses casos, não há muitos tratamentos disponíveis, o que torna esse tipo de pesquisa especialmente importante.
Uma nova possibilidade de tratamento
O selumetinibe pertence a uma classe de medicamentos chamados inibidores de MEK, que foi a primeira a mostrar alguma redução no tamanho dos neurofibromas. Esse remédio não é uma cura, e tem limitações quanto à eficácia e aos efeitos colaterais, mas representa um avanço. Até agora, ele tinha sido estudado apenas em crianças [ver aqui e aqui], e este estudo traz informações importantes sobre seu uso em adultos.
Resultados principais do estudo
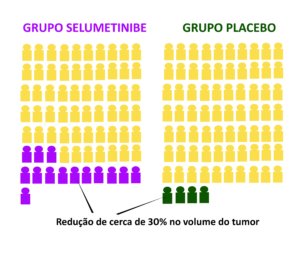
O estudo foi feito em vários centros e envolveu 145 adultos com NF1 e ao menos um neurofibroma plexiforme sintomático e inoperável. Os resultados mostraram que, após 16 ciclos de tratamento, 20% dos pacientes que tomaram selumetinibe tiveram uma redução de pelo menos 34% no volume do tumor. No grupo que tomou placebo (um remédio sem efeito), apenas 5% tiveram alguma redução.
O selumetinibe não foi superior ao placebo na redução da dor, porque houve uma pequena melhora na dor em quem usou o selumetinibe, mas esta redução da dor foi semelhante em quem usou o placebo.
No entanto, o selumetinibe não melhorou a qualidade de vida dos pacientes em comparação com o placebo.
Quais tipos de neurofibromas responderam melhor?
Existem diferentes tipos de neurofibromas: cutâneos (na pele), nodulares e difusos (ver aqui mais detalhes). Esses dois últimos podem formar tumores mais complexos chamados plexiformes, e às vezes afetam todos os nervos que saem da coluna (forma espinhal da NF1).
O estudo não informou se algum desses subtipos respondeu melhor ao tratamento com selumetinibe. Essa informação seria muito útil para orientar melhor os médicos e pacientes sobre quais pessoas têm maior chance de responder melhor ao medicamento.
Por que não foi feito um estudo com troca de grupos?
É uma pena que o estudo não tenha usado um tipo de pesquisa em que TODOS os participantes trocam de tratamento após um tempo (por exemplo, quem começou com placebo passa para o selumetinibe, e vice-versa), o que é comum em estudos com medicamentos de uso crônico.
Só houve uma troca dos pacientes que estavam usando placebo e passaram a usar o selumetinibe.
A falta deste cruzamento limita a utilidade deste estudo da Lancet pois poderíamos ficar sabendo o que acontece quando o tratamento é interrompido: o tumor volta a crescer? O efeito se mantém?
Tolerância ao tratamento em adultos com NF1 de longa duração
Os efeitos colaterais mais comuns do selumetinibe foram problemas de pele, intestinais e no fígado. Cerca de 15% dos pacientes pararam o tratamento por causa desses efeitos. Além disso, o remédio exige monitoramento constante, como exames cardíacos, o que é um desafio, especialmente porque estamos lidando com uma doença crônica e em princípio benigna.
Como os tumores da NF1 geralmente não são malignos, e o remédio só reduz parcialmente o tamanho, é importante pensar com cuidado sobre os riscos e benefícios no longo prazo. Os pacientes devem participar ativamente dessa decisão, e o tratamento deve ser feito com acompanhamento cuidadoso, como ocorre em centros especializados, como o Centro de Referência em Neurofibromatose da UFMG [ver aqui].
Todas as pessoas que precisarem podem ter acesso ao medicamento?
Também lamentamos que o estudo não tenha avaliado se o tratamento é viável do ponto de vista econômico nos adultos. Já sabemos que, para crianças, alguns estudos sugerem que o remédio só seria custo-efetivo se tivesse o preço bastante reduzido ou se o tratamento fosse curto [referências NICE e CADTH]. Mas essa análise ainda falta para os adultos.
Conclusão
O estudo de Chen et al. representa um avanço importante na pesquisa sobre tratamentos para NF1 em adultos. O selumetinibe pode ajudar uma parte dos pacientes com tumores inoperáveis, mas os benefícios ainda são limitados. Há necessidade de mais estudos para:
- Identificar melhor quem tem mais chance de se beneficiar do remédio;
- Entender quais tipos de tumores respondem melhor (nodulares ou difusos);
- Testar combinações de medicamentos diferentes;
- Avaliar os efeitos no longo prazo – o que acontece quando o medicamento é suspenso?
- E verificar se o tratamento é viável do ponto de vista econômico para que todas as pessoas que necessitem dele tenham acesso.
Continuaremos acompanhando os avanços da ciência e informando nossas famílias com transparência e responsabilidade.
Assinam este post a Diretoria da AMANF e a equipe médica do CRNF HC UFMG



