Leandro Cruz Ramires da Silva
Médico cirurgião oncológico mastologista
e coordenador da AMA-ME
O desafio em busca da melhor qualidade de vida para pessoas portadoras de mutações genéticas que determinam condições crônicas, muitas vezes incapacitantes, acompanhadas de muito sofrimento para os próprios pacientes, suas famílias e seus principais cuidadores, acabou proporcionando nosso encontro, há pouco mais de cinco anos, com o Prof. Dr. Luiz Oswaldo Carneiro Rodrigues, coordenador do Centro de Referência em Neurofibromatoses do Hospital das Clínicas da UFMG. Naquela época, eu atuava como coordenador da Mastologia na mesma instituição.
Esse desafio ganha uma dimensão ainda mais significativa quando essas mutações genéticas afetam nossos próprios familiares, nossos filhos e filhas. O fato de sermos médicos e pais nos transporta da convivência com esses pacientes, que antes se limitava ao ambiente hospitalar e ao consultório, para dentro de nossas casas. Aprendemos, de maneira privilegiada, a nos colocar no lugar do outro e a sentir “o peso do piano”. Desenvolvemos uma empatia mais profunda e canalizamos nossos esforços, iniciados desde a graduação em medicina, na busca por conhecimento e alternativas médicas, e não médicas, que possam melhorar a qualidade de vida, minimizando o desconforto e o sofrimento de nossos filhos e, consequentemente, de outros pacientes que compartilham dessas mesmas condições.
Neste contexto, nasceu a Associação Brasileira de pacientes de Cannabis Medicinal (ama-me), que em 2024 completa 10 anos e o Centro de Referência em Neurofibromatose do HC/UFMG, uma realização da Associação Mineira de Apoio aos Portadores de Neurofibromatoses (AMANF), que celebra 20 anos. A ama-me, entidade do terceiro setor sem fins lucrativos, surgiu inicialmente da necessidade de controlar, de forma sustentável, as crises convulsivas de crianças portadoras de epilepsia refratária e autismo, muitas delas decorrentes de doenças de origem genética, como as Síndrome de Dravet, Lennox Gastaut, West, CDKL5 dentre outras.
Nos últimos anos o Sistema Endocanabinoide (SEC)(1), tornou-se um alvo terapêutico muito importante, com evidências científicas cada vez mais crescentes, para:
- Distúrbios de Humor e Ansiedade: O SEC tem sido implicado no tratamento de distúrbios de ansiedade e humor, como Transtorno de Pânico, Transtorno de Ansiedade Social, Transtorno de Ansiedade Generalizada, Transtorno de Estresse Pós-Traumático e Transtorno Obsessivo-Compulsivo
- Câncer: O SEC desempenha um papel significativo no tratamento de vários tipos de câncer. Canabinoides têm demonstrado propriedades apoptóticas, anti-metastáticas, antiangiogênicas e anti-inflamatórias em diferentes modelos de câncer, como câncer de mama, pulmão, próstata, pele, entre outros.
- Doenças Neurológicas/Neurodegenerativas: O SEC é relevante no tratamento de doenças neurodegenerativas, como Esclerose Lateral Amiotrófica (ELA), Doença de Alzheimer, Parkinson, Huntington, entre outras. Os canabinoides possuem propriedades neuroprotetoras e modulam a inflamação, podendo aliviar sintomas associados a essas condições.
- Doenças Autoimunes: O SEC também está implicado no tratamento de doenças autoimunes, como Esclerose Múltipla, Artrite Reumatoide, Doenças Inflamatórias Intestinais (como a Doença de Crohn e Colite Ulcerativa), Lúpus Eritematoso Sistêmico, entre outras. A interação dos canabinoides com os receptores CB1 e CB2 ajuda a regular o sistema imunológico e a resposta inflamatória.
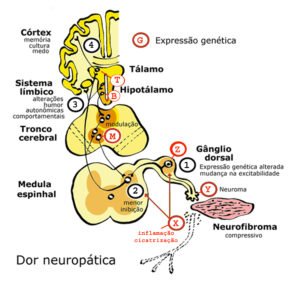
- A neurofibromatose tipo 1 (NF1) é uma das condições monogenéticas mais comuns e está associada a uma variedade de complicações de saúde, incluindo tumores benignos e malignos (como gliomas da via óptica, neurofibromas plexiformes, tumores malignos da bainha dos nervos periféricos e outros tumores do SNC), dores neuropáticas, dores de cabeça, convulsões, ansiedade, depressão, insônia, risco aumentado de constipação e síndrome do intestino irritável, dificuldades de aprendizagem ou atraso na fala, distúrbios de déficit de atenção, escoliose e risco elevado de outros tipos de câncer (como rabdomiossarcomas). Dadas as diversas manifestações, os problemas neurocognitivos e o risco de desfiguração e até mesmo de morte, não é surpreendente que pessoas com NF1 relatem uma diminuição significativa na qualidade de vida(2).
Estudo de longo prazo de uma coorte dinamarquesa de adultos com NF1 mostrou uma frequência aumentada de hospitalizações devido a doenças que afetam todos os sistemas do corpo ao longo de todas as fases da vida. Há um risco significativamente maior de transtornos psiquiátricos, incluindo distúrbios do desenvolvimento, como TDAH (Transtorno de Déficit de Atenção e Hiperatividade) e transtornos do espectro autista, além de maior dificuldade em estabelecer relações sociais. Mulheres com NF1 apresentam um risco aumentado de abortos espontâneos e natimortos. Indivíduos com NF1 relatam uma qualidade de vida reduzida, com uma alta necessidade de apoio profissional para lidar com problemas físicos, psicológicos e relacionados ao trabalho. A gravidade e a visibilidade da doença estão parcialmente associadas ao bem-estar psicossocial e à necessidade de suporte adicional(3).
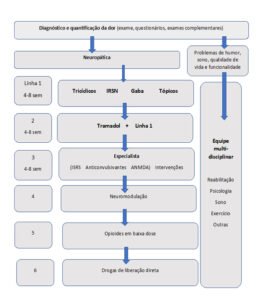
Diante da complexidade dos sintomas associados à convivência com a NF1, o potencial terapêutico da Cannabis utilizada para fins medicinais pode contribuir significativamente para a melhoria da qualidade de vida desses pacientes. Segundo o Mapa de Evidências sobre a Efetividade da Cannabis Medicinal, elaborado pela WeCann Academy em colaboração com a OPAS/BIREME e o CABSIN (disponível no link: https://mtci.bvsalud.org/en/evidence-map-on-effectiveness-of-medicinal-cannabis/), existem evidências robustas que apoiam a eficácia da Cannabis na melhora de condições como dor (crônica, neuropática, oncológica), espasticidade, náuseas e vômitos induzidos por quimioterapia, epilepsia, ansiedade, insônia e doenças inflamatórias intestinais.
Nesse contexto, o uso medicinal da Cannabis torna-se uma opção atraente para pacientes com NF1, oferecendo algumas vantagens consideráveis, tais como:
Segurança: Não há registros de morte por overdose de Cannabis ou de seus derivados naturais.
Tolerabilidade: Em geral, os medicamentos à base de Cannabis são bem tolerados. O principal efeito adverso é o efeito psicoativo desencadeado pelo THC, que é dose-dependente e pode ser minimizado através da combinação com CBD. Além disso, a tolerância aos efeitos psicoativos desenvolve-se rapidamente, permitindo que os pacientes mantenham doses constantes sem necessidade de aumento ao longo do tempo (4).
Acessibilidade: Produtos à base de Cannabis já estão autorizados pela ANVISA e disponíveis em farmácias no Brasil. Além disso, a importação de produtos semelhantes, com maior variedade e menor custo, é possível através de um processo simplificado de obtenção de autorização para importação mediante prescrição médica, disponível no link: https://www.gov.br/pt-br/servicos/solicitar-autorizacao-para-importacao-excepcional-de-produtos-a-base-de-canabidiol.
Redução da polimedicação: O envolvimento do SEC em várias condições fisiopatológicas permite que o uso medicinal da Cannabis possa proporcionar alívio para uma série de condições que, de outra forma, necessitariam de um número maior de medicamentos. Isso, por sua vez, reduz o custo total do tratamento.
Autonomia: Com o tempo, o paciente torna-se capaz de avaliar seus próprios resultados com a terapia fitocanabinoide e fazer ajustes pontuais na medicação para obter melhores resultados.
A terapia com Cannabis para fins medicinais envolve o uso de óleos medicinais, cápsulas, cremes, pomadas, soluções e até supositórios, que podem ser produzidos a partir do extrato de Cannabis, constituído pelo insumo farmacêutico ativo obtido através da extração da resina presente nas flores secas das plantas fêmeas. A aplicação pode ser feita na mucosa oral, sublingual, por via oral ou vaporizada (aspirada). A taxa e a velocidade de absorção, o início do efeito e a metabolização dos fitocanabinoides estão diretamente relacionadas com a via de administração escolhida. As próprias flores secas são reconhecidas como medicinais e podem ser vaporizadas para proporcionar alívio mais rápido da dor.
De modo geral, os medicamentos de Cannabis são classificados em três quimiotipos principais: Quimiotipo I, com predominância de THC; Quimiotipo II, onde existe um equilíbrio entre as concentrações de THC e CBD; e Quimiotipo III, com predominância de CBD. A terapêutica canabinoide difere da terapêutica alopática convencional por ser mais individualizada. O mesmo quimiotipo pode proporcionar conforto e alívio para uma variedade de sintomas em um paciente e não ter a mesma eficácia em outros. A estratégia terapêutica deve começar com doses baixas, sendo os ajustes feitos gradualmente conforme os resultados, sempre dentro do contexto de acompanhamento próximo e de uma boa relação médico-paciente.
Além do CBD e do THC, outros fitocanabinoides (ver tabela 01.) também apresentam potencial terapêutico e podem ser úteis na melhora da qualidade de vida de portadores de NF1. De modo geral, quanto mais próximo da planta inteira for o medicamento, melhor será o efeito terapêutico alcançado. O uso de fitocanabinoides isolados, além de apresentar menor potencial terapêutico, está associado a uma maior possibilidade de efeitos colaterais indesejáveis. O uso da planta inteira favorece o “Efeito Entourage”, que caracteriza a relação sinérgica entre todos os compostos químicos presentes na Cannabis, promovendo melhor tolerabilidade e menos efeitos colaterais.
Tabela 01: Efeitos farmacológicos dos principais fitocanabinoides
| Fitocanabinoides | Efeitos Farmacológicos |
| CDB | Antiepiléptico, antioxidante, anti-inflamatório, antiemético, imunossupressor, antipsicótico, neuroprotetor, antineoplásico |
| Δ 9 -THC | Antioxidante, antipruriginoso, anti-inflamatório, neuroprotetor, analgésico, antineoplásico, antináusea |
| CBG | Antibacteriano, antifúngico, anti-inflamatório, previne a proliferação celular, antineoplásico, antidepressivo, anti-hipertensivo, analgésico |
| CBC | Anti-inflamatório, analgésico |
| CBN | Sedativo, anticonvulsivante, anti-inflamatório, antibiótico, antineoplásico |
| THCV | Perda de peso, anticonvulsivante, anti-hiperalgesia, anti-inflamatório, antineoplásico |
| CBDV | Inibe a degradação endocanabinóide, antináusea, anticonvulsivante, antineoplásico |
Dor crônica, ansiedade, depressão, insônia, síndrome do intestino irritável, espasticidade, crises convulsivas, autismo e câncer são condições clínicas que ocorrem com maior frequência na população com NF1 e serão abordadas de forma individualizada a seguir.
Dor (crônica, neuropática, oncológica)
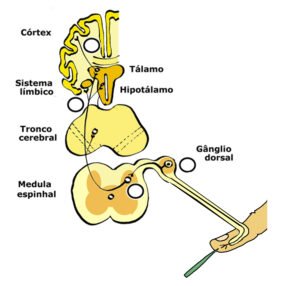
Os receptores canabinoides estão amplamente distribuídos por várias vias de modulação da dor, incluindo neurônios sensoriais centrais e periféricos, regiões do cérebro responsáveis pela discriminação sensorial, circuitos reguladores da dor no tronco encefálico e estados afetivos que modulam as respostas emocionais a estímulos nocivos, como a dor.
Os endocanabinoides AEA e 2-AG podem fornecer uma das primeiras respostas terapêuticas à dor (por exemplo, por meio da modulação dos receptores CB1, CB2, TRPs, PPARs e opioides), desbloqueando uma ou mais vias disponíveis para alcançar efeitos analgésicos.
Terapias baseadas em fitocanabinoides (por exemplo, THC, CBD) têm demonstrado graus variados de eficácia no tratamento dos oito tipos básicos de dor: crônica, aguda, central, periférica, inflamatória, nociceptiva, patológica e mental-emocional.
Um estudo multicêntrico transversal analisou pacientes com dor crônica devido à lesão medular espinhal que usavam regularmente cannabis medicinal (inalada, spray na mucosa oral e óleos medicinais). Esses pacientes relataram melhoras em espasmos (90,3%), padrões de sono (83,5%), sensação de bem-estar (75,4%) e diminuição da ansiedade (69,7%), além de melhora no apetite (53,3%) e na percepção da dor. Os efeitos adversos mais comuns atribuídos ao uso de cannabis medicinal foram boca seca (54,5%), gosto ruim na boca (29,6%), desidratação (28,7%), perda de memória (27,2%), letargia (26,3%), sonolência (21,7%) e constipação intestinal (17,2%). No mesmo estudo, pacientes que não utilizavam cannabis relataram desidratação (42,4%), perda de memória (32,1%), letargia (46,4%), sonolência (49,1%) e constipação intestinal (46,3%), todos esses efeitos adversos foram mais comuns em comparação usuários de Cannabis(5).
Em relação à dor crônica, neuropática ou não, o tratamento com cannabis medicinal busca atingir os seguintes objetivos: melhorar a eficácia analgésica geral, a autonomia, o sono e o humor; reduzir a carga de sintomas específicos da doença, a anedonia, a ansiedade, o uso de opioides, benzodiazepínicos, relaxantes musculares, hipnóticos, anti-inflamatórios não esteroides (AINEs), além do uso de substâncias ilícitas e lícitas (álcool, tabaco)(5).
Como sugestão para o tratamento da dor, o paciente pode iniciar com 5 mg de CBD duas vezes ao dia e aumentar a dosagem em 10 mg/dia (5 mg de CBD 2x ao dia) a cada 2 a 3 dias, até atingir 40 mg de CBD por dia. Se a dose predominante de 40 mg/dia de CBD não atingir os objetivos de tratamento, os médicos podem considerar iniciar com 2,5 mg de THC por dia e aumentar a dosagem em 2,5 mg de THC a cada 2–7 dias, até 40 mg/dia, mantendo a mesma dose predominante de CBD(5).
Ansiedade e depressão
Centenas de estudos foram conduzidos para examinar o envolvimento de todos os componentes do Sistema Endocanabinoide (SEC) no tratamento de transtornos de ansiedade e pânico. Uma porcentagem crescente desses estudos consiste em ensaios clínicos humanos de alta qualidade, incluindo várias revisões sistemáticas e metanálises. A literatura disponível atualmente descreve em detalhes como os fitocanabinoides e outros constituintes da planta de cannabis modulam os fundamentos biológicos e os estados de humor relacionados à ansiedade.
Quando comparados a controles saudáveis, pacientes com ansiedade apresentam alterações na expressão de receptores canabinoides(6), níveis de endocanabinoides(7), suas enzimas metabolizadoras correspondentes(8), além de um tônus endocanabinoide alterado, resultando em sinalização endocanabinoide prejudicada(9).
Em pacientes com ansiedade, uma dose baixa de THC (por exemplo, 1-2 mg/dia) foi eficaz na redução ansiedade sem produzir efeitos adversos significativos(10). Por outro lado, doses iguais ou superiores a 10 mg/dia de THC (administração oral) podem aumentar a ansiedade(11) quando administrado de forma isolada. No entanto, quando administrado na forma de óleo integral “full spectrum” que envolve todos os componentes da planta, o THC é muito seguro até uma dose de 30 mg/dia. A coadministração de THC e CBD é vista como benéfica em comparação ao uso de THC isolado em versão farmacêutica(4). Tratamentos orais com 600 mg de CBD foram capazes de neutralizar a ansiedade induzida por 10 mg de THC em voluntários humanos(12).
O THC pode induzir efeitos ansiolíticos ou, em doses mais altas, efeitos ansiogênicos e paranoicos, ou seja, quanto maior a dose de THC, maior a probabilidade de causar ou agravar estados de ansiedade. Para reduzir esse impacto, a coadministração de CBD e o controle da forma e via de administração são fundamentais.
O CBD induz mudanças de humor suaves e positivas, sem causar alterações na cognição ou sedação. Uma dose de 300 mg de CBD por dia, administrada durante quatro semanas, reduziu significativamente a ansiedade em adolescentes diagnosticados com transtorno de ansiedade social(13). A ação ansiolítica direta do CBD pode ser modulada por meio das vias de receptores de serotonina(14). Indiretamente, a inibição da FAAH pelo CBD pode aumentar a concentração de AEA, ajudando a regular a ansiedade(15).
Os resultados de pesquisas pré-clínicas e clínicas sugerem que o CBG possui propriedades ansiolíticas. O mecanismo pelo qual o CBG atua como ansiolítico ainda não está completamente elucidado, pois evidências “in vivo” e “in vitro” indicam que o CBG pode atuar como um antagonista do receptor 5-HT1A em doses mais altas, diferentemente do CBD(16). Além disso, o CBG pode inibir a recaptação de GABA, contribuindo para o alívio da ansiedade e dos espasmos musculares.
Há um crescente corpo de evidências científicas sugerindo que a homeostase proporcionada pelo Sistema Endocanabinoide (SEC) está envolvida tanto na patogênese quanto no tratamento da depressão. Relatos indicam que a cannabis pode exercer tanto efeitos pró-depressivos quanto antidepressivos, dependendo do quimiotipo utilizado (por exemplo, o uso de um Quimiotipo I de cannabis, com predominância de THC sobre o CBD). Diversos ensaios pré-clínicos demonstraram que a modulação dos receptores canabinoides clássicos, como CB1 e CB2, bem como de outros receptores sensíveis a canabinoides (por exemplo, 5-HT1A/serotonina, adrenérgicos, glutamatérgicos), pode produzir efeitos terapêuticos semelhantes aos dos antidepressivos farmacêuticos.
Dadas as limitações e a falta de resultados positivos a longo prazo dos tratamentos farmacêuticos tradicionais, o mecanismo preciso de modulação do Sistema Endocanabinoide (SEC) para produzir efeitos antidepressivos tornou-se objeto de intensa investigação. Estudos demonstraram que o THC pode produzir tanto efeitos pró-depressivos quanto antidepressivos, provavelmente de forma dose-dependente (quanto maior a dose de THC, maior o risco de efeitos adversos). Em contraste, o CBD tem mostrado resultados predominantemente positivos na mitigação dos sintomas de depressão, apresentando, ao mesmo tempo, um perfil de segurança muito favorável(17). Além disso, vários terpenos comuns da cannabis, como terpineol, beta-cariofileno, limoneno, pineno e linalol, demonstraram eficácia na mitigação dos sintomas da depressão.
Uma revisão sistemática de ensaios clínicos (26) relatou faixas de dosagem efetivas para o uso oral de CBD no tratamento de várias condições, variando entre 1 e 50 mg/kg/dia (com uma média de 15 mg/kg/dia, por exemplo, 1050 mg para uma pessoa pesando 70 kg). No entanto, devido às diferentes sensibilidades individuais, um regime de dosagem baseado em mg/kg pode não ser o método mais preciso; é preferível titular os pacientes a partir de doses iniciais mais baixas. O CBD demonstrou reduzir a ansiedade e a depressão sem causar alterações cognitivas ou efeitos sedativos. Doses a partir de apenas 50 mg/dia, distribuídas em duas ou três administrações diárias, podem apresentar efeitos positivos no controle da ansiedade e depressão. Bons resultados são observados com doses entre 100 e 150 mg de CBD por dia.
Insônia
A Cannabis tem sido usada há milênios para ajudar as pessoas a terem um boa noite de sono. A AEA, um agonista dos receptores CB1, aumenta o sono de ondas lentas e o sono REM (movimento rápido dos olhos), além de reduz a vigília(18), favorecendo a ocorrência de sonhos. Os fitocanabinoides THC e CBN, ambos agonistas nos mesmos receptores, demonstraram efeitos indutores do sono semelhantes, sendo que a combinação de THC e CBN apresenta efeitos indutores do sono mais significativos do que o THC sozinho e muito mais do que o CBN isoladamente(19).
Além do SEC, outros receptores como os de serotonina, dopamina, GABA e receptores adrenérgicos, também respondem favoravelmente a endocanabinoides, fitocanabinoides e terpenos, auxiliando na indução e regulação do humor e o sono. Os efeitos do uso de fitocanabinoides individuais são dose-dependentes, ou seja, a quantidade de um único canabinoide (THC, CBD, CBN) pode determinar resultados indesejados se for excessiva ou insuficiente. A proporção entre THC, CBN e CBD, bem como a presença de outros constituintes da planta, como terpenos (por exemplo, mirceno, linalol e limoneno), pode desempenhar um papel significativo na determinação do que funcionará melhor para cada paciente. Facilitar o adormecimento, promover um sono profundo, garantir sonhos sem pesadelos, manter o sono durante a noite e evitar a sonolência residual no dia seguinte são os principais objetivos da terapia com fitocanabinoides em busca da melhor qualidade do sono.
O THC pode promover o sono e reduzir o tempo necessário para adormecer, mas também pode causar sonolência matinal ou, em dosagens mais altas ou em indivíduos mais sensíveis, provocar pânico e ansiedade, piorando a insônia. Embora o THC possa ajudar a lidar com pesadelos relacionados ao estresse pós-traumático, pessoas que consomem grandes e frequentes quantidades de THC podem relatar uma ausência completa de sonhos.
O CBN tem uma sinergia significativa com o THC e pode ser especialmente vantajoso em casos em que o THC sozinho não é suficiente para promover o sono. Embora estudos clínicos diretos sejam escassos, revisões sistemáticas e um estudo duplo-cego sugerem começar com uma dose noturna de THC entre 2,5 a 10 mg, associada a CBN na faixa de 20 mgou mais como ponto de partida (20).
O CBD também possui um efeito bifásico dependente da dose: auxilia na qualidade do sono em dosagens de 50 a 160 mg/dia(21, 22), mas induz a vigília em dosagens em doses de 15 mg/dia(23).
Síndrome do Cólon irritável
O tratamento da dor visceral em pacientes com distúrbios da interação intestino-cérebro, como a síndrome do intestino irritável (SII), apresenta um desafio clínico considerável, com poucas opções terapêuticas disponíveis. Cada vez mais, os pacientes têm recorrido à cannabis e aos canabinoides para controlar a dor abdominal. A cannabis atua nos receptores do sistema endocanabinoide, um sistema endógeno de mediadores lipídicos que regula a função gastrointestinal e as vias de processamento da dor, tanto em condições normais quanto patológicas. O sistema endocanabinoide representa, portanto, um alvo terapêutico molecular lógico para o tratamento da dor associada à síndrome do intestino irritável(24). No que diz respeito à SII, não há dados que sugiram a superioridade de um quimiotipo em detrimento de outro, o que oferece flexibilidade para os pacientes escolherem a opção que melhor ajude a controlar seus sintomas.
Espasticidade
A eficácia do Quimiotipo II (CBD e THC em proporções semelhantes) no tratamento da espasticidade decorrente de esclerose múltipla foi estudada em quatro ensaios clínicos randomizados e controlados por placebo, todos demonstrando resultados positivos. Esses estudos avaliaram o uso do spray bucal Mevatyl® (Quimiotipo II, com 27 mg/ml de THC e 25 mg/ml de CBD), e as doses variavam entre os pacientes. Em média, seis a doze aplicações diárias mostraram-se eficazes no controle da espasticidade. Óleos medicinais integrais de Cannabis ricos em THC, utilizados por via sublingual apresentam resultados a partir de 4,0 mg/dia divididas em três ou quatro tomadas.
Epilepsia e autismo
Mais de uma centena de estudos primários, incluindo vários ensaios clínicos, examinaram diretamente os componentes do sistema endocanabinoide no contexto do tratamento da epilepsia. Agora, temos uma base científica relativamente sólida que nos permite tomar decisões mais sábias e práticas sobre que tipo de cannabis e quais compostos específicos provavelmente produzirão resultados anticonvulsivantes ideais da forma mais segura possível.
Mais de 40 estudos clínicos, incluindo ensaios rigorosos aprovados pela FDA, avaliaram a eficácia de um quimiotipo III de cannabis (com predominância de CBD e pouco ou nenhum THC) ou de um produto farmacêutico purificado à base de CBD, demonstrando potencial terapêutico para a epilepsia. Em pacientes com a síndrome de Dravet, o canabidiol, utilizado na dose de 20 mg/kg/dia em adição ao tratamento antiepiléptico padrão, ao longo de 14 semanas, resultou em uma redução significativa na frequência de convulsões em comparação ao placebo, embora tenha sido associado a taxas mais elevadas de eventos adversos(25).
Pacientes autistas tratados com medicamentos à base de cannabis ricos em CBD e THC, numa proporção Pacientes autistas tratados com medicamentos à base de cannabis ricos em CBD e THC, numa proporção de 20:1 (ou seja, 20 partes de CBD para uma de THC), apresentaram melhora na maioria dos principais sintomas do autismo, além de uma melhoria na qualidade de vida dos pacientes e suas famílias. Nesses casos, os efeitos colaterais são geralmente leves e pouco frequentes. Além disso, a alotriofagia (hábito de comer substâncias que não são alimentos) pode ser tratada com medicamentos à base de cannabis. Os resultados favoráveis alcançados com óleos medicinais integrais de cannabis também contribuem para a redução ou suspensão de outros medicamentos, diminuindo, assim, os efeitos adversos associados a esses tratamentos (26).
É importante ter em mente que há diferenças significativas entre produtos medicinais de cannabis da planta inteira, CBD de espectro completo ou amplo, e a forma farmacêutica isolada do CBD. Os benefícios específicos da forma farmacêutica não necessariamente se aplicam a todos os produtos de cannabis ou CBD, devido às variações na qualidade e nos processos de fabricação.
Quimioterapia, cuidados paliativos, náusea e vômitos
Até o momento, a literatura científica disponível apoia, favorece ou, na pior das hipóteses, sugere a necessidade de mais estudos sobre o uso de terapias baseadas em canabinoides no contexto de cuidados paliativos. Vários ensaios clínicos em humanos testaram direta e especificamente os efeitos dos canabinoides em cuidados paliativos. Recentemente, um estudo clínico randomizado e duplo-cego, realizado em 2023, relatou que a maioria dos participantes se sentiu “melhor” ou “muito melhor” após 14 e 28 dias de tratamento com óleo de CBD (dose média de 400 mg, concentração de 100 mg/ml, administrado de 0,5 ml uma vez ao dia até 2,0 ml três vezes ao dia). No entanto, não houve diferença significativa em outros desfechos, como qualidade de vida, depressão e ansiedade, conforme demonstrado em estudos anteriores(27).
A cannabis tem se mostrado um remédio eficaz para o tratamento de náuseas e vômitos induzidos pela quimioterapia. Ao longo das últimas cinco décadas, uma vasta quantidade de literatura científica tem confirmado esse uso histórico dos constituintes da planta (principalmente THC e, em menor grau, THCA, CBD e CBDA) e elucidado uma série de mecanismos receptores precisos (principalmente via CB1, mas também via 5-HT1A e TRPV1) pelos quais os canabinoides produzem seus efeitos terapêuticos em casos de náusea e vômito induzidos pela quimioterapia.
Além disso, o CBD oral tem demonstrado ser eficaz na prevenção da neuropatia periférica aguda e transitória induzida por quimioterapia, quando administrado na dose de 150 mg de óleo de CBD duas vezes ao dia (300 mg/dia) por 8 dias, começando 1 dia antes do início da quimioterapia(28).
Em 2020, um estudo apresentado e publicado pela European Society for Medical Oncology (ESMO) considerou 81 pacientes elegíveis que apresentavam náuseas e vômitos induzidos por quimioterapia intravenosa hematogênica, apesar da profilaxia antiemética consistente com as diretrizes. Esses pacientes foram randomizados para receber tratamento com cannabis medicinal. O tratamento consistiu em um ciclo de 1 a 4 cápsulas de THC 2,5 mg/CBD 2,5 mg, administradas três vezes ao dia. A adição de THC e CBD orais aos antieméticos padrão foi associada a uma redução nas náuseas e vômitos, e a maioria dos participantes preferiu o tratamento com THC e CBD ao placebo, mesmo na presença de efeitos colaterais, como sedação, tontura ou desorientação(29).
À medida que a ciência avança e os benefícios terapêuticos da cannabis medicinal se tornam cada vez mais evidentes, o preconceito contra seu uso por parte de pacientes e médicos está, lentamente, dando lugar a uma compreensão mais informada e compassiva. Para pacientes portadores de neurofibromatoses, a cannabis medicinal oferece uma nova esperança para o manejo de sintomas complexos e debilitantes. A crescente aceitação de tratamentos à base de cannabis reflete uma mudança significativa na mentalidade médica, focada não apenas em tratar a doença, mas em melhorar a qualidade de vida. Esta evolução no entendimento e na prática clínica sinaliza um futuro onde a cannabis medicinal será cada vez mais vista como uma opção legítima e valiosa para o tratamento de condições crônicas impostas pelas neurofibromatoses.
Bases farmacológicas da Cannabis medicinal
A Cannabis, nome científico da maconha, é uma planta angiospérmica que existe em nosso planeta há aproximadamente 32 milhões de anos e é utilizada com fins medicinais desde 2.700 a.C., além de ser fonte de fibras para tecidos e cordoaria há mais de 12.000 anos. De origem asiática, a maconha surgiu no noroeste daquele continente, em regiões montanhosas do Himalaia, norte da Índia e na parte mais ocidental da China. Em seu habitat natural, as plantas da família Cannabaceae, do gênero Cannabis, são distribuídas em três espécies: Sativa, Indica e Ruderalis. Domesticada há milénios pela humanidade, atualmente existem centenas de variedades de cannabis, obtidas através de cruzamentos botânicos, que se diferenciam principalmente pelas concentrações de seus componentes químicos: fitocanabinoides, terpenos e flavonoides.
Os fitocanabinoides são uma classe estruturalmente diversa de constituintes químicos naturais do gênero Cannabis. Essa classificação química é amplamente baseada na derivação de um precursor conhecido como ácido canabigerólico (CBGA) ou seu análogo, o ácido canabigerovárico (CBGVA), resultando na produção de aproximadamente 140 moléculas. Essas moléculas, isoladamente ou em conjunto com outros constituintes químicos da planta, produzem efeitos medicinais que variam do sistema nervoso central (SNC) ao sistema imunológico. Os mais conhecidos incluem o Delta-9-tetrahidrocanabinol (THC), principal responsável pelo efeito psicoativo, o Canabidiol (CBD), o Canabigerol (CBG), o Canabinol (CBN) e a Tetrahidrocanabivarina (THCV), entre outros(30).
Desde os anos 80, um estudo brasileiro pioneiro, duplo-cego, prospectivo e randomizado, coordenado pelo Prof. Dr. Elisaldo Carlini, confirmou o benefício do Canabidiol (CBD), um fitocanabinoide, no controle de crises convulsivas em pacientes adultos(31). Naquela época o mecanismo de ação dos fitocanabinoides era desconhecido.
Ainda no final da década de 80, foi identificado, nas células nervosas, o código do DNA responsável pelo surgimento de Receptores Canabinoides de membrana celular conhecidos como CB1 abundantes nas células do SNC e periférico(32). Um segundo receptor, conhecido como CB2, foi identificada por homologia de sequência e presume-se que esteja presente na periferia, principalmente em células do sistema imunológico(33). Hoje, sabemos que CB2 também está presente no SNC. Os receptores CB1 e CB2 são bem caracterizados como receptores acoplados a proteína transmembrana G. Ambos reconhecem várias classes de compostos agonistas e antagonistas, produzindo uma variedade de efeitos celulares distintos a jusante. Polimorfismos naturais e variantes de splicing alternativo também podem contribuir para a diversidade farmacológica. À medida que o conhecimento sobre eles cresce, adquirimos a capacidade de direcionar conformações específicas dos receptores e suas respostas farmacológicas correspondentes(34).
Uma vez descobertos, os receptores canabinoides CB1 e CB2 foram identificados em diversas células do organismo humano, e sua distribuição é crucial para o entendimento do potencial terapêutico do Sistema Endocanabinoide (SEC)(1):
- CB1: Está densamente presente no cérebro, em áreas responsáveis pela memória, aprendizagem, coordenação motora, regulação de hormonal, percepção sensorial, recompensa, emoções e temperatura corporal. No tronco cerebral, área crucial para manutenção da vida, a concentração é inexpressiva. Além disso, CB1 também é encontrado em níveis mais baixos em outras partes do sistema nervoso central e em tecidos periféricos, como o fígado, o tecido adiposo e o sistema gastrointestinal.
- CB2: Este receptor é predominantemente encontrado nas células do sistema imunológico, como macrófagos e micróglia, e em células envolvidas em processos inflamatórios. A expressão de CB2 é alta em células imunes, e sua ativação está associada a propriedades imunossupressoras, como a indução de apoptose em células T e macrófagos, e a regulação da liberação de citocinas pró-inflamatórias.
Em 1992, Mechoulam e seu grupo identificaram a Anandamida (AEA), um endocanabinoide, produzido pelo próprio organismo, derivado do ácido araquidônico, que interage com o receptor CB1 de forma agonista(35). Em 1995, o mesmo grupo descreveu outro endocanabinoide, trata-se de uma molécula análoga à anandamida contendo um radical glicerol, o 2-arachidonoyl-glycerol (2AG), localizado no intestino de ratos, que apresentava afinidade pelos receptores canabinoides, embora com menos intensidade que o THC(36). A produção de AEA e 2AG ocorrem sob demanda a partir de precursores de fosfolipídios da membrana celular por múltiplas vias biossintéticas, ou seja, apenas quando necessário, em resposta a estímulos fisiológicos. Não existem reservatórios endógenos de endocanabinoides.
As enzimas precursoras dos endocanabinoides incluem N-aciltransferase (NAT) e N-acilfosfatidiletanolamina (NAPE-PLD) para a síntese de AEA e diacilglicerol (DAGLα/β) para a síntese de 2AG. Após cumprirem sua função, os endocanabinoides são metabolizados pelas enzimas Amida de ácidos graxos hidrolase (FAAH), que degrada a anandamida AEA, e a monoacetilglicerol lipase (MAGL), que degrada o 2AG. A inativação seletiva das enzimas de metabolização (FAAH e MAGL) representa uma abordagem promissora. O CBD tem sua ação potencializada porque é um inibidor da FAAH(37).
Receptores canabinoides CB1 e CB2; seus ligantes endocanabinoides AEA e 2AG, suas enzimas precursoras NAT, NAPE-PLD, DAGLα/β, e suas enzimas de metabolização FAAH E MAGL, compõem o Sistema Endocanabinoide (SEC) que está intrinsecamente relacionado a várias funções fisiológicas essenciais para manter a homeostase do organismo. Esse sistema abriu novas frentes de pesquisa, evidenciando seu papel não apenas na transmissão de estímulos nervosos, mas também no sistema imunológico (7). Os fitocanabinoides e outros canabinoides sintéticos interagem direta e indiretamente com os receptores canabinoides e outros receptores, ampliando o potencial terapêutico, como exemplificado abaixo(1):
- Receptor GPR55: É considerado um receptor canabinoide “órfão”, tem sido proposto como um receptor canabinoide tipo 3. GPR55 está envolvido em várias funções fisiológicas, incluindo a modulação da dor e a regulação da pressão arterial, e pode mediar efeitos inflamatórios.
- Receptores TRPV1 (Transient Receptor Potential Vanilloid 1): Embora não seja um receptor canabinoide clássico, o TRPV1 interage com os endocanabinoides como a anandamida. Esse receptor é conhecido por sua função na detecção e regulação da temperatura corporal e na modulação da dor.
- Receptores PPARs (Peroxisome Proliferator-Activated Receptors): São receptores nucleares que também podem ser ativados por endocanabinoides. Os PPARs desempenham um papel crucial na regulação do metabolismo, na inflamação e na homeostase energética.
No sistema nervoso, quando ocorre uma sobrecarga de estímulos a partir do neurônio pré-sináptico, os neurônios pós-sinápticos iniciam produção aumentada de AEA e/ou 2AG que atuam de maneira retrograda, ocupando receptores específicos no neurônio pré-sináptico. Essa ocupação leva à redução do estímulo nervoso, uma vez que a membrana neuronal se modifica para reter os neurotransmissores, cessando, assim, a continuidade do estimulo nervoso.
Assim como o SEC promove a modulação do sistema nervoso, a ação dos endocanabinoides nos receptores CB2, nas células do sistema imunológico, promove seu equilíbrio, impedindo seu funcionamento exacerbado. Ambas as ações são fundamentais para a manutenção da vida. O SEC é um sistema molecular vital manter a homeostase.
Homeostasia, do grego “homeo” (igual) e “stasis” (estático), é a condição de relativa estabilidade necessária para que o organismo realize suas funções adequadamente. É a propriedade de um sistema aberto, especialmente dos seres vivos, de regular seu ambiente interno, mantendo uma condição estável por meio de múltiplos ajustes de equilíbrio dinâmico, controlados por mecanismos de regulação inter-relacionados.
O SEC foi detectado na Hydra vulgaris, uma pequena espécie de cnidário de água doce, que mede entre 10 e 30 milímetros, que surgiu há aproximadamente 600 milhões de anos. Esse organismo, um dos mais primitivos com um sistema nervoso rudimentar, possui receptores canabinoides semelhantes aos encontrados em mamíferos e é capaz de produzir anandamida. Caracterizada por seu corpo tubular e simétrico radialmente, com uma extremidade contendo tentáculos que envolvem uma cavidade bucal(38), a Hydra é um exemplo de como o desenvolvimento do SEC foi fundamental para o processo evolutivo da vida em nosso planeta.
No ser humano, o SEC está implicado em uma ampla gama de processos fisiológicos e fisiopatológicos, incluindo o desenvolvimento do sistema nervoso, função imune, inflamação, apetite, dor, ciclos de vigília/sono, regulação do metabolismo e da energia, homeostase, função cardiovascular, digestão, reprodução, desenvolvimento e densidade óssea, plasticidade sináptica e aprendizado, regulação do estresse, estado emocional e humor, bem como em doenças psiquiátricas, psicomotoras, comportamentais, de memória e autoimunes.
Referências:
- Lowe H, Toyang N, Steele B, Bryant J, Ngwa W. The Endocannabinoid System: A Potential Target for the Treatment of Various Diseases. Int J Mol Sci. 2021;22(17).
- Fjermestad KW, Nyhus L, Kanavin Ø J, Heiberg A, Hoxmark LB. Health Survey of Adults with Neurofibromatosis 1 Compared to Population Study Controls. J Genet Couns. 2018;27(5):1102-10.
- Doser K, Hove H, Østergaard JR, Bidstrup PE, Dalton SO, Handrup MM, et al. Cohort profile: life with neurofibromatosis 1 – the Danish NF1 cohort. BMJ Open. 2022;12(9):e065340.
- MacCallum CA, Russo EB. Practical considerations in medical cannabis administration and dosing. Eur J Intern Med. 2018;49:12-9.
- Stillman M, Capron M, Mallow M, Ransom T, Gustafson K, Bell A, et al. Utilization of medicinal cannabis for pain by individuals with spinal cord injury. Spinal Cord Ser Cases. 2019;5:66.
- Neumeister A, Normandin MD, Pietrzak RH, Piomelli D, Zheng MQ, Gujarro-Anton A, et al. Elevated brain cannabinoid CB1 receptor availability in post-traumatic stress disorder: a positron emission tomography study. Mol Psychiatry. 2013;18(9):1034-40.
- Wilker S, Pfeiffer A, Elbert T, Ovuga E, Karabatsiakis A, Krumbholz A, et al. Endocannabinoid concentrations in hair are associated with PTSD symptom severity. Psychoneuroendocrinology. 2016;67:198-206.
- Lazary J, Eszlari N, Juhasz G, Bagdy G. Genetically reduced FAAH activity may be a risk for the development of anxiety and depression in persons with repetitive childhood trauma. Eur Neuropsychopharmacol. 2016;26(6):1020-8.
- Thornton AM, Humphrey RM, Kerr DM, Finn DP, Roche M. Increasing Endocannabinoid Tone Alters Anxiety-Like and Stress Coping Behaviour in Female Rats Prenatally Exposed to Valproic Acid. Molecules. 2021;26(12).
- Fabre LF, McLendon D. The efficacy and safety of nabilone (a synthetic cannabinoid) in the treatment of anxiety. J Clin Pharmacol. 1981;21(S1):377s-82s.
- Raymundi AM, da Silva TR, Sohn JMB, Bertoglio LJ, Stern CA. Effects of ∆(9)-tetrahydrocannabinol on aversive memories and anxiety: a review from human studies. BMC Psychiatry. 2020;20(1):420.
- Bhattacharyya S, Morrison PD, Fusar-Poli P, Martin-Santos R, Borgwardt S, Winton-Brown T, et al. Opposite effects of delta-9-tetrahydrocannabinol and cannabidiol on human brain function and psychopathology. Neuropsychopharmacology. 2010;35(3):764-74.
- Masataka N. Anxiolytic Effects of Repeated Cannabidiol Treatment in Teenagers With Social Anxiety Disorders. Front Psychol. 2019;10:2466.
- Campos AC, Guimarães FS. Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats. Psychopharmacology (Berl). 2008;199(2):223-30.
- Papagianni EP, Stevenson CW. Cannabinoid Regulation of Fear and Anxiety: an Update. Curr Psychiatry Rep. 2019;21(6):38.
- Russo EB, Cuttler C, Cooper ZD, Stueber A, Whiteley VL, Sexton M. Survey of Patients Employing Cannabigerol-Predominant Cannabis Preparations: Perceived Medical Effects, Adverse Events, and Withdrawal Symptoms. Cannabis Cannabinoid Res. 2022;7(5):706-16.
- Denson RK, Brooks J, Pinna G, Crane NA. Effects of Cannabidiol in Adolescent and Young Adult Depressive and Anxiety Disorders: A Systematic Review of Clinical and Preclinical Research. Adolesc Psychiatry (Hilversum). 2023;13(3):176-94.
- Murillo-Rodríguez E, Sánchez-Alavez M, Navarro L, Martínez-González D, Drucker-Colín R, Prospéro-García O. Anandamide modulates sleep and memory in rats. Brain Res. 1998;812(1-2):270-4.
- Lavender I, McGregor IS, Suraev A, Grunstein RR, Hoyos CM. Cannabinoids, Insomnia, and Other Sleep Disorders. Chest. 2022;162(2):452-65.
- Bonn-Miller MO, Feldner MT, Bynion TM, Eglit GML, Brunstetter M, Kalaba M, et al. A double-blind, randomized, placebo-controlled study of the safety and effects of CBN with and without CBD on sleep quality. Exp Clin Psychopharmacol. 2024;32(3):277-84.
- Kisiolek JN, Flores VA, Ramani A, Butler B, Haughian JM, Stewart LK. Eight Weeks of Daily Cannabidiol Supplementation Improves Sleep Quality and Immune Cell Cytotoxicity. Nutrients. 2023;15(19).
- Carlini EA, Cunha JM. Hypnotic and antiepileptic effects of cannabidiol. J Clin Pharmacol. 1981;21(S1):417s-27s.
- Nicholson AN, Turner C, Stone BM, Robson PJ. Effect of Delta-9-tetrahydrocannabinol and cannabidiol on nocturnal sleep and early-morning behavior in young adults. J Clin Psychopharmacol. 2004;24(3):305-13.
- Brierley SM, Greenwood-Van Meerveld B, Sarnelli G, Sharkey KA, Storr M, Tack J. Targeting the endocannabinoid system for the treatment of abdominal pain in irritable bowel syndrome. Nat Rev Gastroenterol Hepatol. 2023;20(1):5-25.
- Devinsky O, Cross JH, Wright S. Trial of Cannabidiol for Drug-Resistant Seizures in the Dravet Syndrome. N Engl J Med. 2017;377(7):699-700.
- Montagner PSS, Medeiros W, da Silva LCR, Borges CN, Brasil-Neto J, de Deus Silva Barbosa V, et al. Individually tailored dosage regimen of full-spectrum Cannabis extracts for autistic core and comorbid symptoms: a real-life report of multi-symptomatic benefits. Front Psychiatry. 2023;14:1210155.
- Hardy J, Greer R, Huggett G, Kearney A, Gurgenci T, Good P. Phase IIb Randomized, Placebo-Controlled, Dose-Escalating, Double-Blind Study of Cannabidiol Oil for the Relief of Symptoms in Advanced Cancer (MedCan1-CBD). J Clin Oncol. 2023;41(7):1444-52.
- Nielsen SW, Hasselsteen SD, Dominiak HSH, Labudovic D, Reiter L, Dalton SO, et al. Oral cannabidiol for prevention of acute and transient chemotherapy-induced peripheral neuropathy. Support Care Cancer. 2022;30(11):9441-51.
- Grimison P, Mersiades A, Kirby A, Lintzeris N, Morton R, Haber P, et al. Oral THC:CBD cannabis extract for refractory chemotherapy-induced nausea and vomiting: a randomised, placebo-controlled, phase II crossover trial. Ann Oncol. 2020;31(11):1553-60.
- Thomas BF, ElSohly MA. Chapter 2 – Biosynthesis and Pharmacology of Phytocannabinoids and Related Chemical Constituents. In: Thomas BF, ElSohly MA, editors. The Analytical Chemistry of Cannabis: Elsevier; 2016. p. 27-41.
- Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel C, Gagliardi R, et al. Chronic administration of cannabidiol to healthy volunteers and epileptic patients. Pharmacology. 1980;21(3):175-85.
- Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature. 1990;346(6284):561-4.
- Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature. 1993;365(6441):61-5.
- Howlett AC, Abood ME. CB(1) and CB(2) Receptor Pharmacology. Adv Pharmacol. 2017;80:169-206.
- Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science. 1992;258(5090):1946-9.
- Mechoulam R, Ben-Shabat S, Hanus L, Ligumsky M, Kaminski NE, Schatz AR, et al. Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem Pharmacol. 1995;50(1):83-90.
- Maccarrone M, Bab I, Bíró T, Cabral GA, Dey SK, Di Marzo V, et al. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol Sci. 2015;36(5):277-96.
- De Petrocellis L, Melck D, Bisogno T, Milone A, Di Marzo V. Finding of the endocannabinoid signalling system in Hydra, a very primitive organism: possible role in the feeding response. Neuroscience. 1999;92(1):377-87.