Neste passo, vamos ver os principais problemas e sintomas causados pelos plexiformes que foram tratados com selumetinibe no estudo da Dra. Gross nos Estados Unidos.
Queremos ajudar você a saber o que você pode esperar com o tratamento.
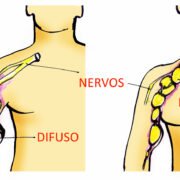
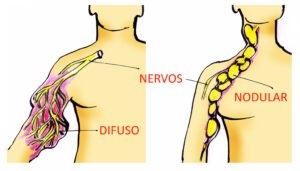
Metade dos plexiformes apresenta uma ou mais das seguintes consequências:
- Deformidades físicas
- Dor
- Perda de alguma função
A – Se sua queixa principal sobre o plexiforme for a deformidade física, você precisa saber que no estudo da Dra. Gross e colaboradores (2020) (ver aqui) o selumetinibe reduziu o tamanho do tumor de forma duradoura (mais de um ano de uso constante do medicamento) em 1 em cada 2 crianças (ou adolescentes) que usaram o medicamento.
Nenhuma criança apresentou cura, ou seja, o tumor não desapareceu em nenhuma delas.
Esta redução nestas crianças e adolescentes foi entre 30 e 40% do tamanho inicial, quer dizer, se o plexiforme tinha um volume de um litro, por exemplo, o selumetinibe reduziu cerca de 2 copos aproximadamente.
Você precisa então pensar se esta redução de 30% já seria suficiente para melhorar a deformidade causada pelo plexiforme. Se esta redução faria com que você se sentisse mais confortável porque as outras pessoas estariam percebendo menos o seu plexiforme, por exemplo.
Se você acha que a possível redução de 40% do tumor é suficiente para você enfrentar os riscos e custos do medicamento (ver adiante), vá para o passo seguinte (Passo 4).
B – Se o problema principal causado pelo plexiforme for a dor, que pode ser muito forte em algumas pessoas, você precisa saber que a redução do tamanho do plexiforme observada com o selumetinibe em metade das crianças e adolescentes não foi relacionada com a melhora da dor.
Nós também temos dúvidas se o estudo da Dra. Gross comparou corretamente a dor nas pessoas que usaram o selumetinibe, pois a dor é um sentimento subjetivo e pode ser afetada pelo simples uso de uma cápsula colorida achando que é um remédio, o que chamamos de efeito placebo.
E a Dra. Gross não comparou o selumetinibe com algum comprimido placebo.
Então, se a dor é sua queixa principal, seria interessante você realizar um tratamento rigoroso para a dor, seguindo a escada analgésica (ver aqui) antes de considerar o uso do selumetinibe
Mas se você já tentou esta escada analgésica e não está funcionando, e tem esperança de que o selumetinibe possa reduzir sua dor, vá para o passo seguinte (Passo 4).
C – Por fim, sua queixa principal quanto ao plexiforme pode ser a perda de alguma função. Então vamos ver alguns exemplos das perdas funcionais mais comuns causadas pelos plexiformes.
- Se você apresenta perda do movimento de um braço ou uma perna, por exemplo, você precisa saber que estas perdas são causadas precocemente pelo desenvolvimento do plexiforme desde a vida intrauterina e não há evidência de que elas possam ser modificadas pelo uso do selumetinibe.
Talvez seja melhor você investir em outros cuidados para melhorar sua capacidade funcional.
- Se você apresenta dificuldade para respirar por obstrução das vias aéreas por causa do plexiforme, o selumetinibe apresentou redução da compressão da traqueia em alguns casos especiais, permitindo a retirada da traqueostomia, e isto pode ser uma indicação para você experimentar o selumetinibe, então vá para o passo seguinte (Passo 4).
- Dificuldade visual por causa de invasão do olho pelo plexiforme, você precisa saber que a presença crônica do plexiforme nas proximidades dos olhos pode realmente obstruir a visão, causar glaucoma (aumento da pressão ocular) ou proptose (deslocamento do globo ocular para fora da órbita). Essas são consequências graves do plexiforme que provavelmente não serão modificadas pelo uso do selumetinibe.
Se você deseja rever os passos anteriores CLIQUE AQUI
Se deseja seguir adiante (Passo 4) CLIQUE AQUI