Este espaço é destinado a opinião de pessoas com experiência em diversos assuntos relacionados com as neurofibromatoses.

A nossa Coordenadora Clínica do Centro de Referência em Neurofibromatoses (CRNF), e também nossa Diretora Científica da AMANF, Dra. Juliana Ferreira de Souza apresentou alguns de seus conhecimentos sobre NF no IV Congresso Brasileiro de Neurogenética, em São Paulo, realizado de 13 a 15 de março de 2025.
Vejamos seu relato.
Foi um evento apoiado pela Academia Brasileira de Neurologia, voltado para a comunidade de neurologistas, neurologistas infantis, geneticistas clínicos e pesquisadores interessados na genética das doenças neurológicas.
O tema deste congresso foi “Analisando o passado, Construindo o futuro” e a proposta foi de discutir os conceitos fundamentais da genética úteis à prática de cuidado das síndromes clínicas clássicas, as principais técnicas diagnósticas e avanços terapêuticos. Foram convidados profissionais de destaque dos principais centros brasileiros e do exterior.
Como coordenadora do CRNF do Hospital das Clínicas da Universidade Federal de Minas Gerais, fui convidada pela comissão organizadora a participar do evento, abordando o tema “Atualizações em Neurofibromatoses”.
Fui uma das palestrantes da sessão de Neurogenética Geral (crianças), que aconteceu na manhã do dia 14/03/25 e foi moderada pela Professora Vanessa Van Der Linden (Recife-PE). Esta sessão contou, ainda, com as palestrantes Dra. Carolina Moreno, de Paulina-SP, que abordou “As bases genéticas das cranioestenoses” e a Dra. Débora Bertola, de São Paulo-SP, que abordou “Rasopatias: muito além da síndrome de Noonan”.
Por tratar-se de módulo destinado aos acometimentos pediátricos, as atualizações que abordei ficaram praticamente restritas à Neurofibromatose tipo 1 (NF1), e somente mencionei a nova nomenclatura proposta para a “antiga” Neurofibromatose tipo 2 (NF2), agora denominada Schwannomatose relacionada ao gene NF2 e a “antiga” Schwannomatose, agora com 4 denominações distintas, a depender do gene envolvido.
Sobre a NF1, apresentei três temas:
- os critérios diagnósticos revistos em 2021;
- o surgimento de opções de tratamentos sistêmicos (inibidores da MEK) para os neurofibromas plexiformes sintomáticos e inoperáveis em crianças e, mais recentemente, a aprovação pelo FDA para seu uso em adultos;
- os avanços nas técnicas cirúrgicas para o tratamento da pseudoartrose de tíbia e da escoliose distrófica.
A discussão e os comentários que se desenrolaram após as apresentações demonstraram o interesse dos participantes do congresso pela NF1, bem como o reconhecimento da experiência acumulada pelos profissionais do CRNF ao longo destes 20 anos de atividades assistenciais e de pesquisa dedicados às “Neurofibromatoses”.
Minha impressão, ao participar pela primeira vez deste congresso, foi a de que o nosso CRNF compartilha alguns dilemas com outros serviços de referência em outras síndromes neurogenéticas, tais como:
- diagnóstico tardio, dificuldade de acesso a serviços de referência;
- dificuldade da APS em coordenar o cuidado destas pessoas;
- dificuldade de acesso aos exames complementares (quer para diagnóstico e/ou acompanhamento, no SUS ou na saúde suplementar);
- custo elevado das inovações destinadas ao diagnóstico e/ou tratamento e judicialização do acesso a estas inovações;
- limitações para incorporação da tecnologia pelo SUS.
Todos estes temas foram abordados durante o evento. Por outro lado, percebo a minha participação como uma oportunidade de abrir um canal de comunicação e colaboração com profissionais de uma área do conhecimento, a neurogenética, que tem grande potencial de oferecer avanços no cuidado de pessoas com NF1 e Schwannomatoses.
Novamente agradeço à comissão organizadora do IV Congresso Brasileiro de Neurogenética pelo convite e pela oportunidade de conversar sobre as “Neurofibromatoses”.
Foi uma ótima experiência!!


Algumas famílias que nos procuram no Centro de Referência em Neurofibromatoses (CRNF) do Hospital das Clínicas da UFMG dizem que ficaram sabendo que nós, do CRNF e da AMANF, somos CONTRA o medicamento selumetinibe (nome comercial Koselugo).
Isto não é verdade porque temos indicado o medicamento para algumas crianças e adolescentes que possuem neurofibromas plexiformes que estão causando dor ou perda de função e que não possam ser removidos por meio de cirurgia, de acordo com nosso protocolo de cuidados já publicado.
Desde que o medicamento foi lançado, já indicamos o selumetinibe para cerca de uma dezena de crianças e adolescentes que preencheram os critérios que adotamos para indicar a nova droga.
Nossos critérios foram estabelecidos depois de muitos meses de estudos da nossa equipe para fornecermos uma orientação segura para as pessoas com NF1.
Esta orientação está disponível na página da AMANF e sempre está sendo atualizada. Clique neste link para acessar nossa orientação.
Quem ler nossa opinião verá que consideramos os chamados inibidores MEK (como o selumetinibe e outras drogas) podem ser eficazes para reduzir os tumores plexiformes em uma parte das crianças e adolescentes que as utilizam, e esperamos que no futuro seja desenvolvida uma nova fórmula, que alcance resultados clínicos melhores do que os atuais, com menos efeitos adversos e com custo acessível e disponível pelo SUS.
Assim, esta inverdade que anda sendo dita contra o CRNF e a AMANF somente causa insegurança e, portanto, mais sofrimento para as famílias que já sofrem com a NF1 e os plexiformes.
O compromisso do CRNF e da AMANF é com o bem estar de todas as pessoas que atendemos e é por isso que continuaremos a usar as ferramentas científicas de que dispomos para verificar a eficácia de qualquer tratamento que surgir e vamos sempre divulgar nossa opinião.
Contamos com você para ajudar a desfazer esse mal entendido e divulgar o nosso trabalho, que é aberto a todas as pessoas, realizado no SUS e de Utilidade Pública.
Pelo CRNF
Dra, Juliana Ferreira de Souza
Dr, Bruno César Lage Cota
Dr. Nilton Alves de Rezende
Dr. Luiz Oswaldo Carneiro Rodrigues
Dra. Luíza de Oliveira Rodrigues
Dra. Luciana Imaculada de Paula
Enf. Marina Corgosinho
Pela AMANF
Adriana Venuto (Presidenta)
Luiz Oswaldo Carneiro Rodrigues (Diretor Administrativo)
Juliana Ferreira de Souza (Diretora Científica)
Marcos Vinicius Soares Vieira (Diretor Financeiro)
Fabiana Amélia Reis Pantuzza
Márcia Cristina Monteiro Campos
Tânia Marília Silva Corgosinho
Maria Helena Rodrigues Vieira

Avaliação Técnica e Científica do estudo que motivou a aprovação da droga Mirdametinibe para tratamento de neurofibromas plexiformes sintomáticos inoperáveis nos Estados Unidos
Realizada pela Dra. Luíza de Oliveira Rodrigues a pedido do CRNF e da AMANF
Destinada a fornecer informações a profissionais da saúde, ao Sistema Único de Saúde, aos órgãos públicos reguladores (ANVISA e CONITEC) e planos de Saúde Suplementar.
Avaliação Técnica do Ensaio Clínico chamado ReNeu: A Pivotal, Phase IIb Trial of Mirdametinib in Adults and Children With Symptomatic Neurofibromatosis Type 1-Associated Plexiform Neurofibroma (ver aqui o artigo completo – em inglês)
Qualidade da evidência: muito baixa, de acordo com os critérios do GRADE (estudo de fase 2b, multicêntrico, não randomizado, de braço único, aberto, desfecho primário substituto, financiado pelos fabricantes do mirdametinibe).
Incluiu 2 coortes: 1 de crianças e 1 de adultos, com NF1 e com PN inoperável, radiologicamente mensurável, causando morbidade significativa.
Não há definição formal de “morbidade significativa” na descrição do método; infere-se, pela introdução, que seja: dor, deslocamento/compressão de órgãos, comprometimento da função física e desfiguração (sem definição formal) e deterioração da qualidade de vida relacionada à saúde (QVRS) de pacientes e cuidadores.
O desfecho primário foi a taxa de resposta objetiva confirmada (ORR), definida como a proporção de pacientes com uma redução ≥20% na ressonância magnética (RM) do volume do PN alvo, da linha de base ao ciclo 24 (fase de tratamento), avaliada por revisão central independente cega em ≥2 exames consecutivos dentro de 2-6 meses.
Os desfechos secundários de eficácia incluíram duração da resposta (DoR) e mudança da linha de base ao ciclo 13, pré-especificado, para desfecho relatado pelo paciente (PRO) ou medidas de desfecho relatadas por procuração dos pais de pior gravidade da dor do tumor (Escala de Avaliação Numérica-11 [NRS-11]), interferência da dor (Índice de Interferência da Dor [PII]), e HRQOL (Inventário Pediátrico de Qualidade de Vida, versão 4.0 [PedsQL 4.0]).
As coortes incluíram pacientes muito heterogêneos, com PNs de volumes muito pequenos até muito grandes:
-
- Coorte de crianças (2 a 17 anos, mas mediana de 10 anos) com 56 participantes, com PNs variando de 5 a 3.630 mL.
- O volume mediano foi de 99 mL, o que significa que metade dos pacientes na coorte das crianças tinha tumores de menos de 99 mL e metade tinha tumores de mais de 99 mL.
- Destes, 62% eram considerados progressivos e 38% não progressivos.
- 70% tinham dor, 50% desfiguração ou deformidade maior (sem definição destas variáveis), 27% tinham disfunção motora e 12% tinham disfunção de via aérea.
- Coorte de crianças (2 a 17 anos, mas mediana de 10 anos) com 56 participantes, com PNs variando de 5 a 3.630 mL.
- 6 destas 56 crianças já tinham recebido inibidor de MEK antes
-
- Coorte de adultos (18 a 69 anos, mas mediana de 34 anos) com 58 participantes, com PNs variando de 1 a 3.457 mL.
- O volume mediano foi de 196 mL. Destes, 53% eram considerados progressivos e 47% não progressivos.
- 90% tinham dor, 52% desfiguração ou deformidade maior (sem definição destas variáveis), 40% tinham disfunção motora e 5% tinham disfunção de via aérea.
- Coorte de adultos (18 a 69 anos, mas mediana de 34 anos) com 58 participantes, com PNs variando de 1 a 3.457 mL.
- 4 dos 58 participantes já tinham recebido inibidores de MEK.
O uso prévio de outro iMEK foi proibido depois de uma modificação do protocolo, durante a execução do estudo.
O ensaio compreendeu uma fase de tratamento de 24 ciclos, uma fase de tratamento opcional de acompanhamento de longo prazo (LTFU) e um período de acompanhamento de segurança de 30 dias após a descontinuação do tratamento.
Os pacientes podiam continuar recebendo mirdametinibe até que qualquer um dos seguintes ocorresse: progressão da doença radiográfica confirmada centralmente, eventos adversos intoleráveis (EAs), incapacidade de aderir ao protocolo ou descontinuação determinada pelo paciente ou pelo investigador.
Desfechos em adultos:
- ORR: 41% dos adultos teve resposta objetiva (> ou = a 20% de redução do volume do PN alvo após 24 ciclos); E mais 2 adultos (3,4%) tiveram resposta objetiva na fase LTFU (nos ciclos 28 e 32). E 75% dos pacientes que tiveram resposta, ou seja, 18 pacientes, tiveram duração de pelo menos 12 meses de resposta. O tempo mediano para atingir a resposta foi de cerca de 7,8 meses.
- A mediana de tempo em tratamento foi de 21,8 meses (variando de 0,4 a 45,6) e a mediana de duração da resposta ainda não havia sido alcançada;
- A melhor porcentagem mediana de redução no volume foi de –41% (intervalo, –90 a +13); 62% dos adultos (ou seja, 15 de 24) com uma resposta objetiva confirmada atingiram uma redução máxima da linha de base de >50% (ou seja, 26% dos adultos tiveram uma redução de >50% dos seus tumores).
- 84% dos adultos que concluíram a fase de tratamento optaram por ingressar na LTFU (o estudo não fala quantos concluíram a fase de tratamento; mas como 13 (22%) descontinuaram o tratamento por eventos adversos, esses 84% não podem ser mais que 38 pacientes, mesmo que somente 24 (41% de 58) tenham tido resposta objetiva.
- Entre os adultos que puderam alcançar uma melhora clinicamente significativa (definida no Suplemento de Dados, Seção I https://ascopubs.org/action/downloadSupplement?doi=10.1200%2FJCO.24.01034&file=DS_JCO.24.01034.pdf):
- 17 (29% de 58) alcançaram uma melhora clinicamente significativa em Escala de Avaliação Numérica-11 da dor;
- 13 (22% de 58) alcançaram uma melhora clinicamente significativa em interferência da dor (Índice de Interferência da Dor [PII]
- 17 (29% de 58) alcançaram uma melhora clinicamente significativa em Inventário Pediátrico de Qualidade de Vida, versão 4.0 [PedsQL 4.0]
- Ou seja, em termos de melhora clínica, cerca de ⅓ dos pacientes apresentou alguma melhora clínica (que foi ainda menor que os 41% que apresentaram redução de tamanho do tumor na ressonância).
- É importante ressaltar que a avaliação de desfechos subjetivos em estudos abertos é significativamente enviesada, pois não pode ser balizada pelo efeito placebo.
Houve bastante toxicidade (98%), sendo que 16% foram de grau maior ou igual a 3. Os eventos adversos relacionados ao tratamento (TRAEs) relatados em ≥20% dos adultos foram dermatite acneiforme (78%), diarreia (48%), náusea (36%), vômito (28%) e fadiga (21%). Dezoito adultos (31%) experimentaram uma interrupção da dose, 10 (17%) foram submetidos à redução da dose e 13 (22%) descontinuaram o tratamento devido a EAs.
Portanto, a magnitude do benefício, no desfecho de taxa de resposta objetiva, segundo os critérios da ESMO (Form 3 Para estudos de braço único em “doenças órfãs” e para doenças com “alta necessidade não atendida” quando o resultado primário é PFS ou ORR https://www.esmo.org/content/download/117393/2059180/1/ESMO-MCBS-Version-1-1-Evaluation-Form-3.pdf), pode ser considerada grau 3 (ORR >20 e <60% e duração de mais de 9 meses), que é moderada. Porém, vale lembrar que essa escala foi desenvolvida para avaliar pacientes com câncer (ou seja, tumores malignos) e pode, portanto, superestimar o benefício no tratamento de neurofibromas plexiformes de histologia benigna, que é uma doença crônica.
Em crianças, os resultados foram semelhantes:
- Vinte e nove crianças (52%; IC 95%, 38 a 65) alcançaram uma resposta objetiva confirmada pelo BICR durante a fase de tratamento
- Uma criança adicional obteve uma resposta confirmada (início ocorreu no ciclo 32) no LTFU.
- 22 (76%) respostas objetivas confirmadas permaneceram duráveis, tendo atingido ou excedido 12 meses em resposta.
- A duração mediana do tratamento foi de 22,0 meses (variação de 1,6-40,0)
- A melhor variação percentual mediana no volume do PN alvo foi de –42% (intervalo, –91 a +48).
- 15 crianças (27% das 56 crianças) com uma resposta objetiva confirmada atingiram uma redução máxima da linha de base de >50%.
- No ciclo 13, uma melhora clinicamente significativa em relação à linha de base foi alcançada em 8 crianças (14,3% de 56) para NRS-11, 5 (9%) para PII relatado pelo paciente, 6 (11% de 56) para PII relatado pelos pais, 13 (23% de 56) para PedsQL Total Score relatado pelo paciente e 15 (27% de 56) para PedsQL Total Score relatado pelos pais (Suplemento de Dados, Fig S5).
- Ou seja, em termos de melhora clínica, assim como para os adultos, menos de ⅓ dos pacientes apresentou alguma melhora clínica (que foi ainda menor que os 41% que apresentaram redução de tamanho do tumor na ressonância).
- É importante ressaltar que a avaliação de desfechos subjetivos em estudos abertos é significativamente enviesada, pois não pode ser balizada pelo efeito placebo.
- O tratamento foi bastante tóxico; 95% tiveram evento adverso, sendo que TRAEs ocorrendo em ≥20% das crianças foram dermatite acneiforme (43%), diarreia (38%), paroníquia (30%), náusea (21%), fração de ejeção diminuída (20%) e aumento da CPK (20%). Dezessete crianças (30%) tiveram uma interrupção da dose, sete (12%) foram submetidas a uma redução da dose e cinco (9%) descontinuaram o tratamento devido a eventos adversos.
- 85% das crianças que completaram a fase de tratamento escolheram entrar na LTFU (também não fala quantas completaram a fase de tratamento), mas 5 interromperam o tratamento devido a eventos adversos, então, não mais que 43 crianças passaram pra LTFU, mesmo que somente 29 delas tenham tido redução do tumor e no máximo 15 delas tenha tido melhora clínica.
A magnitude do benefício para as crianças, no desfecho da taxa de resposta objetiva, segundo os critérios da ESMO também pode ser considerada grau 3 (ORR >20 e <60% e duração de mais de 9 meses), que é moderada. Porém, vale lembrar que essa escala foi desenvolvida para avaliar pacientes com câncer (ou seja, tumores malignos) e pode, portanto, superestimar o benefício no tratamento de neurofibromas plexiformes de histologia benigna, que é uma doença crônica.
A comparação indireta da coorte de crianças que recebeu mirdametinibe com uma coorte histórica (ajustada para diversas variáveis) revelou a curva de tempo para evento (Kaplan-Meier) abaixo:
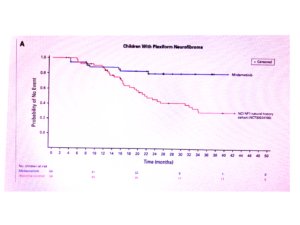
Essas curvas apresentam taxas de censura muito diferentes entre os grupos e, portanto, é uma análise ainda imatura para o grupo mirdametinibe (nem a mediana foi atingida ainda neste grupo). Portanto, é uma comparação espúria, até que a coorte do mirdanetinibe tenha um tempo maior de acompanhamento e menos censuras.
Pontos importantes:
- Não houve correlação da magnitude da resposta com o volume do PN;
- Não houve correlação da melhora clínica com a redução do volume do PN;
- Aparentemente a maioria dos pacientes, incluindo aqueles que mantiveram a resposta, ainda estão em uso da medicação;
- O estudo não foi projetado para avaliar a durabilidade da resposta fora do tratamento ou os benefícios clínicos sustentados após a suspensão do tratamento;
- A duração ideal do tratamento não foi avaliada no ensaio clínico;
- Assim como com outros inibidores de MEK, os potenciais efeitos colaterais de longo prazo ou de surgimento tardio e o benefício potencial da terapia de longo prazo ainda não foram demonstrados, especialmente em crianças.
Em resumo:
É uma droga com o potencial de reduzir (em cerca de 40% a 50%) o volume dos plexiformes em cerca de 1 a cada 2 ou 3 pessoas, mas não são necessariamente os maiores plexiformes que têm mais chance de reduzir. Também pode produzir alguns benefícios clínicos em 1 em cada 3 a 4 pessoas (não necessariamente as mesmas que tiveram a redução do tumor). Esses efeitos parecem levar cerca de 8 meses para aparecer, cerca de 13 meses para atingir o pico e mantêm-se estáveis, na maioria das pessoas, enquanto tomam o medicamento. Porém, o medicamento é bastante tóxico, causando efeitos colaterais em quase todas as pessoas, efeitos que afetam o cotidiano e o bem-estar das pessoas, como dermatite acneiforme, diarreia, náusea, vômito e fadiga. Como os neurofibromas plexiformes são crônicos, e o remédio não oferece cura, pode ser que a pessoa tenha que tomar esse medicamento de forma contínua para manter os efeitos, pois não se sabe se os efeitos perduram quando a pessoa para de tomar. Porém, não se sabe ainda como o uso, por mais de 2 anos, desse medicamento pode afetar a saúde das pessoas e o crescimento e desenvolvimento das crianças. Além disso, o medicamento é muito caro e provavelmente não será custo-efetivo para os sistemas de saúde no mundo todo, inclusive para o nosso SUS e a nossa Saúde Suplementar.



