
Dra Juliana faz seu breve relato do último dia do evento (24/06/25).
O último dia foi dedicado aos estudos translacionais (das ciências básicas para a clínica), com muita ciência básica e conjecturas quanto a possíveis usos futuros em estudos clínicos.
A chave de ouro para este encontro, já muito interessante e proveitoso até aqui, foi a palestra do Dr. Luis Parada. Aquele show de sempre! A palestra dele foi a última da Conferência e, ainda assim, estava cheia.
As atividades de hoje demonstram que os estudos translacionais (aqueles que são feitos in vitro e em modelos animais) seguem acontecendo (independentemente do uso mais amplo dos iMEK) com a testagem de novos compostos possivelmente úteis para o tratamento dos tumores relacionados às Neurofibromatoses.
Aqui vão algumas notas no apagar das luzes.
Modelo Celular de células de Schwann humanas (estudos in vitro) – drogas testadas: trametinibe, BETi e fimepinostat (nome em inglês) produzem apoptose em cultura de células de Schwann – possível alvo em tratamento futuro?
A questão da perda total da neurofibromina (segundo hit)
A Nf1 está associada a diferentes variantes somáticas em células normais (esta apresentação mostra como a questão do segundo hit é incerta na nf1). O que parece é que os sinais e sintomas da NF1 estão geralmente associados ao segundo hit somático.
Segundos hits em células que parecem morfologicamente normais, quer este segundo hit aconteça cedo ou tarde na embriogênese, mantém-se sob seleção positiva, especialmente em tecidos derivados do neuroectoderma e do baço.
O estudo apresentado mostrou isso em células do cérebro e da medula.
Ver foto abaixo.

Palestra do Dr. Luis Parada – avanços nas pesquisas para Tumor maligno da bainha do nervo periférico (MPNST). As drogas testadas: Gliodicine e Gichol (nomes em inglês). A principal mensagem foi no sentido de buscar alvos terapêuticos no metabolismo das células neoplásicas e, não exclusivamente, na variante patogênica que elas apresentam. Os resultados apresentados são preliminares e ainda não publicados. Aguardamos a publicação.
A conferência deste ano foi ótima e fico satisfeita de ter participado. Fica o desejo de estarmos presentes, em Denver, no ano que vem!

No quarto dia da Conferência do CTF em Washington (Estados Unidos), a Dra. Juliana Souza participou de alguns painéis e palestras e nos enviou seus comentários.
Carnitina para fadiga e fraqueza muscular na NF1 (Dra. Berman, da Austrália)
A proposta é estudar a suplementação de carnitina para melhorar a redução de força de adultos e crianças com NF1 (ver foto acima do estudo em fase 3).
A pesquisadora apresentou estudos com modelos animais e um estudo em fase 2 em crianças, com resultados e limitações, financiado pelo CTF, com 6 pacientes, mas os resultados, conforme fala da pesquisadora, foram animadores.
Estes estudos deram origem ao atual “Strength Trial” que está na fase 3, em andamento, com 20 voluntários, entre 12 e 17 anos.
Ficamos felizes em saber que nosso estudo no CRNF, sobre força muscular na NF1, foi a base deste projeto na Austrália (ver aqui trabalho de 2009 e aqui informações sobre força na NF1 em portugues).
Aguardemos estes novos resultados!!!
Quanto aos demais temas, nossas leitoras e leitores da AMANF vão nos desculpar, mas a temática foi destinada a pessoas muito especializadas nestes assuntos, o que torna bastante difícil evitarmos os termos técnicos, mas quem desejar saber mais, envie-nos um e-mail.
Painel – Abordagem das manifestações clínicas que se confundem com NF1 e Schwannomatoses
Manchas café com leite isoladas (Dr. De Luca, de Roma)
Diante da complexidade das doenças que envolvem o sistema nervoso e a pele (chamadas de facomatoses), devemos solicitar o painel genético de rasopatias para todos os pacientes que tiverem só MCL e efélide? Esta pergunta surgiu porque num caso de MCL isolada foi encontrada variante no gene LZTR1 (que está relacionado a rasopatias e schwannomatose), apesar do aspecto benigno, inicial, desta variante.
Neurofibromatose intestinal (Dr. Eric Legius, da Bélgica)
Reapresentação de um caso de Neurofibromatose Intestinal Hereditária, publicado pelo Riccardi pela primeira vez – vale a pena a atenção para as manifestações gastrointestinais em pessoas com NF1.
Neuropatia hipertrófica nas rasopatias (Dra. Dhamija, dos Estados Unidos)
A maior parte dos casos apresentados acontece na Síndrome de Noonan, são identificados por ultrassom e há dificuldade em diferenciar esta hipertrofia de um neurofibroma plexiforme no caso da NF1.
O Dr. Legius falou da importância de buscar por este tipo de alteração, especialmente na presença de dor neuropática.
Nota pessoal: lembrei do caso de uma paciente do CRNF com características semelhantes e acho importante revermos este caso.
Tumores da bainha do nervo periférico (Dr. Ronellenftisch, da Alemanha)
Tem sido identificada variante patogênica no gene ERBB2, que produz tumor em nervo periférico, causando edema e dor neuropática, mais comum em mulheres (interferência hormonal?) sem outros estigmas da NF1 e com mais de uma raiz nervosa acometida.
Variante genética comum a cinco casos de neurofibromatose espinhal ( Dra. Hashemi, da Holanda)
Foi encontrada uma variante genética patogênica no gene NF1 do tipo splice, que causou a forma espinhal da neurofibromatose em cinco pessoas. A neurofibromatose espinhal (SNF) é uma forma da NF1, caracterizada por neurofibromas bilaterais (comprovados histologicamente) de todas as raízes espinhais (e, eventualmente, de todos os principais ramos dos nervos periféricos) com ou sem outras manifestações da NF1 clássica.
Foi lembrado que a forma espinhal apresenta menos de 2% de pessoas sintomáticas e de 24-40% assintomáticas.
Foi comentado o estudo de Ruggieri et al ( 2015) que reviram 98 casos de SNF publicados e encontraram 3 grupos : A) famílias com a forma espinhal, B) indivíduos isolados com a forma espinhal; C) neurofibromas em múltiplas raízes mas não em todas. Além da redução da incidência de manchas café-com-leite, outras manifestações da NF1 foram menos frequentes. O teste molecular mostrou anormalidades comuns do gene NF1 em ambos os grupos, mas o risco de desenvolver SNF estava aumentado nas mutações tipo missense.
O diagnóstico genético parece estar recomendado para diagnóstico diferencial da forma espinhal com schwannomatose e outros genes.
Dr. Fisher compartilhou um caso de uma paciente que ele acompanha desde os 15 anos, agora com 30 anos, com todas as raízes nervosas acometidas e um tumor abdominal, com uma mutação KRAS, que usou o selumetinibe, com boa resposta do tumor abdominal, mas com crescimento acelerado das lesões espinhais exigindo interrupção do iMEK. Assim, sugeriu o cuidado na identificação genética e molecular destes pacientes antes de usar iMEK.
Terapias direcionadas aos problemas ósseos (Dr. Rios, dos Estados Unidos)
Foi observada melhora da densidade óssea ao tratar neurofibromas plexiformes próximos com iMEK, daí surgindo a pergunta se a medicação seria útil para o osso.
Mostrou que a patogênese molecular da pseudoartrose é a perda do segundo alelo (duplo hit), ocorrendo alterações metabólicas nas células NF1-/- da fratura nas cascatas MAPK e ERK, o que levou a um estudo in vitro – para células da fratura da pseudoartrose – com inibidores MEK, ainda em andamento.
Deformidades espinhais na NF1 (Dra. Larson, dos Estados Unidos)
Apresentou o analisador de escoliose em iPhone e indicou o guideline para o manejo das deformidades ósseas, semelhante ao adotado no CRNF ( ver aqui). Considerou o tratamento indicado para curvaturas grandes >40°/60° e sugeriu imagem – radiografia/TC duas vezes ao ano (de baixa dosagem) nos pacientes com escoliose com maior risco de ser distrófica. Lembrou a impossibilidade de fazer ressonância magnética depois da cirurgia que precisa colocar instrumentos metálicos para alongar a coluna.
A Dra. Andrea Gross comentou que alguns pacientes do estudo do Selumetinibe tinham neurofibromas plexiformes junto à coluna vertebral que responderam ao iMEK, mas seu defeito ósseo seguiu evoluindo.
Entendendo a displasia óssea na NF1 (Dra. Elefteriou, dos Estados Unidos)
A hipótese para o surgimento da displasia seria a perda total da neurofibromina (duplo hit) no osteoblasto, desencadeando uma situação de senescência do microambiente, que produziria os efeitos nos ossos.
Isso explicaria a melhor resposta à associação do iMEK com os bifosfonatos, de onde vem a proposta de usar algo que possa interromper a senescência dos osteoblastos.
Amanhã teremos as notícias do último dia do evento!


No quarto dia da Conferência do CTF em Washington (Estados Unidos), a Dra. Juliana Souza participou de painéis e palestras e nos traz os comentários dos participantes do evento sobre a sessão de posters onde ela apresentou outro trabalho científico desenvolvido em nosso CRNF (ver aqui nos anais do Congresso os resumos em inglês).
A seguir o resumo do nosso trabalho apresentado (em português).
Título
A terapia com inibidores de MEK pode ser descontinuada com segurança em um neurofibroma plexiforme responsivo? Um relato de caso
Souza JF (M.D., Ph.D.); Rezende NA (M.D., Ph.D.), Cota BCL (M.D., Ph.D.), Rodrigues LO (M.D., M.Sci.), Rodrigues LOC (M.D., Ph.D.). Centro de Referência Ambulatorial de Neurofibromatose (CRNF), Hospital das Clínicas (HC), Universidade Federal de Minas Gerais (UFMG), Brasil, rodrigues.loc@gmail.com
Introdução
O uso de inibidores de MEK (MEKi) tem sido recomendado para o tratamento de neurofibromas plexiformes sintomáticos inoperáveis (ISPN) em indivíduos com tipo de neurofibromatose (NF1) (1,2). Seguindo nosso protocolo de atendimento clínico para terapia MEKi no tratamento de ISPN (3), iniciamos o tratamento em um paciente do sexo masculino de 9 anos (DBF) com um extenso neurofibroma nodular em formato plexiforme afetando a pelve e o membro inferior direito (Figura 1A), acompanhado de dor neuropática intratável sem resposta à terapia anterior, incluindo imatinibe. O PET-CT pré-tratamento não mostrou transformação maligna. O acesso ao selumetinibe foi concedido por ordem judicial, e a terapia oral começou a ser de 25 mg/m² , duas vezes ao dia em ciclos de 28 dias a partir de dezembro de 2023.
Objetivo deste resumo
Explorar considerações clínicas sobre a descontinuação da terapia com selumetinibe, com foco no momento mais adequado, critérios e estratégias para interromper o tratamento com segurança sem causar crescimento tumoral ou recorrência da dor neuropática, seja devido à preferência do paciente ou limitações financeiras (4).
Métodos
Os exames de ressonância magnética foram realizados a cada 6 meses, pois a análise volumétrica de ressonância magnética não estava disponível em nossa instituição. Os níveis de dor foram avaliados usando uma escala de dor padronizada e as medições da circunferência da coxa foram feitas antes e durante o tratamento (dezembro de 2023 a abril de 2025) (Ver gráfico abaixo).
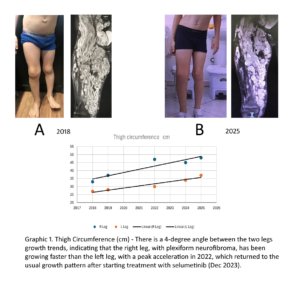
Figura 1 – Fotos dos membros inferiores de uma criança com NF1 acompanhada no CRNF por 8 anos, com ressonância magnética mostrando a extensão do neurofibroma nodular (do tipo plexiforme) e a evolução do perímetro das coxas ao longo dos anos, com e sem selumetinibe.
Resultados
Após 3 meses de tratamento, DBF relatou melhora significativa no controle da dor, uso de analgésicos não opioides de forma intermitente, e melhora na qualidade de vida, incluindo o retorno às atividades físicas na escola. Além disso, a família do paciente relatou uma percepção subjetiva de crescimento lento do ISPN, embora a ressonância magnética não tenha mostrado uma redução no tamanho do tumor (Figura 1B). O Gráfico 1 ilustra as mudanças na circunferência da coxa de 2018 a 2025. Em abril de 2025, as avaliações clínicas indicaram melhora sustentada da dor, qualidade de vida e diminuição da taxa de crescimento do tumor (Figura 1B), com eventos adversos mínimos relatados.
Conclusão
A avaliação clínica mais recente levou a uma avaliação entre a família do paciente e a equipe médica sobre os próximos passos do tratamento. Dado que o medicamento é aprovado pela FDA (e pela ANVISA no Brasil) sem protocolo prescrito para descontinuação quando as respostas ao tratamento são favoráveis, a questão de quando e como interromper a terapia permanece obscura.
Acreditamos que é hora de a comunidade NF se envolver em uma discussão completa sobre os resultados da interrupção da terapia MEKi para neurofibromas plexiformes. Esse diálogo é particularmente importante para apoiar melhor os indivíduos que podem não ser capazes de tolerar os efeitos colaterais, não podem pagar pelo tratamento ou preferem interromper a medicação.
Palavras-chave: neurofibromatose, neurofibromas plexiformes, inibidores de MEK, selumetinibe, cuidados clínicos Conflito de interesse: nenhum. Financiamento da AMANF – Associação Mineira de Apoio aos Portadores de Neurofibromatose
Referências
- Selumetinib in children with inoperable plexiform neurofibromas. Gross AM, Wolters PL, Dombi E, et al. N Engl J Med. 2020;382:1430–1442.
- Selumetinib in children with neurofibromatosis type 1 and asymptomatic inoperable plexiform neurofibroma at risk for developing tumor-related morbidity. Gross AM, Glassberg B, Wolters PL, et al. Neuro Oncol. 2022;24:1978–1988.
- Clinical Care Protocol to use selumetinib as a treatment for inoperable plexiform neurofibromas – a proposal. Rodrigues LO, Rezende NA, Cota BCL, et al. European Neurofibromatosis Meeting, 2020, Rotterdam. European Neurofibromatosis Meeting Abstracts & Presentations, 2020. https://amanf.org.br/atendimento-medico/selumetinibe/
- Challenges of selumetinib therapy for neurofibromatosis in a resource-limited setting. Khalaf T M, Alqadhi A A. 2025. Cureus 17(3): e81071.
Alguns dos comentários de participantes do evento que compareceram ao poster.
- Um médico falou sobre o que aconteceu quando ele interrompeu o uso do selumetinibe numa pessoa com glioma óptico (provavelmente uma paciente de algum estudo clínico) e houve a necessidade de trocar para a quimioterapia tradicional (no caso do glioma há esta opção, mas não nos neurofibromas): a paciente teve efeitos colaterais (dermatológicos) mais intensos após a puberdade (acne) com o selumetinibe e o glioma voltou a crescer com a interrupção da medicação.
- Outro médico, norte americano (que já trabalhou em Curitiba), conversou com colegas sobre o mesmo dilema enfrentado com um adolescente usando selumetinibe para um neurofibroma difuso mediastinal e mencionou uma proposta de redução progressiva da dose (desmame), evitando interrupção súbita. Ambos falaram de novo crescimento do tumor após a interrupção da medicação.
- A maior parte das pessoas compartilhou que este é um grande dilema que elas também têm enfrentado. Todas estão em busca de informações sobre o que acontece com a interrupção dos iMEK. Uma das médicas disse que o título do nosso pôster deveria ser “a questão de um milhão de dólares”.
- Houve relatos de pacientes, na maior parte adolescentes, que perguntam quanto tempo mais terão que usar o medicamento.
No geral, a percepção foi de que este tema é muito importante e está presente em diversos paineis, conferências e temas livres (posters) do evento.
AMANHÃ TRAREMOS A CONTINUAÇÃO DO RELATO DOS PAINEIS E CONFERÊNCIAS DA SEGUNDA FEIRA 23/06/25
