Relatos da Dra. Juliana Souza e do Dr. Bruno Cota
Sábado (21/06/25)
CTF presta homenagem ao nosso amigo e pioneiro Vincent Riccardi
A homenagem póstuma ao Dr. Vincent M. Riccardi (falecido em 2024 aos 83 anos) foi um momento de grande emoção para todas as pessoas que tiveram a oportunidade de conviver com aquele que, antes de todo mundo, se envolveu profundamente com as pessoas com NF.
Riccardi esteve por duas vezes em nosso CRNF (ver aqui um desses momentos) onde deixou lições de sabedoria e espírito científico. Veja a homenagem da comunidade NF dos Estados Unidos ao Riccardi, com uma fotografia que fiz dele e de sua querida Susan no Parque Lagoa do Nado em Belo Horizonte.
Além de ser um referência internacional, estimulou nossas linhas de pesquisa e nos apoiou internacionalmente.
Vamos continuar nosso trabalho com a mesma dedicação que Riccardi nos ensinou, como uma forma de homenagear esta pessoa que tanto nos inspira.
Riccardi vive em nossos corações e mentes.
Dr. Lor
Os outros assuntos do dia foram comentados pela Dra. Juliana e Dr. Bruno foram: :
- Aula espetacular da Dra. Nancy Ratner sobre neurofibromas
- Preservação da audição nas pessoas com NF2
- Inteligência artificial – usos e limitações nas NF
- Tratamento da transformação maligna dos neurofibromas
- Como medir o volume dos neurofibromas
Confira abaixo nossos resumos
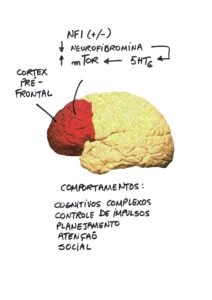
Formação dos neurofibromas, segundo a Dra. Nancy Ratner
Inicialmente, ela mostrou que a perda do segundo alelo do gene NF1 na célula de Schwann dá início aos neurofibromas (que podem ser plexiformes), mas isto não é suficiente para a transformação maligna, pois é preciso a ocorrência de outros fatores.
Em seguida, mostrou a importância dos estudos pré clínicos no avanço na utilização dos inibidos MEK (iMEK) nos estudos clínicos. Chamou a atenção para as vias SHP2 e KRAS, para as quais já há uma droga (BI-6674) em estudo pré-clínico, em preparação para publicação, assim como outros potenciais alvos.
Mostrou um diagrama com diversas drogas que tentam bloquear outras etapas da cascata e que foram capazes de encolher os neurofibromas plexiformes em modelos animais.
Relatou que a ideia atual é começar a associar estas drogas, embora ainda não haja efeito durável ou combinação que possa produzir um encolhimento maior dos neurofibromas plexiformes.
Mostrou que os neurofibromas plexiformes têm cerca de 30% de células do sistema imunitário: macrófagos, células dendríticas e células T e que tanto os iMEK quanto os iSHP2 diminuem a população de macrófagos e células dendríticas. De maneira um pouco menos dramática nos humanos do que no modelo animal, mas ainda assim importante
Destacou o fato de que as células de Schwann Nf-/Nf- expressam fatores que atraem células T e células dendríticas, enquanto os macrófagos estão dentro das células tumorais no início da sua formação e promovem seu crescimento. Drogas anti macrófagos no início da formação inibem o surgimento dos plexiformes e diminuem um pouco seu tamanho depois de formados.
Quando células B e T não estão presentes, neurofibromas plexiformes não se formam e os macrófagos estão diminuídos. Se você oferece anticorpos anti células T (ver poster de Jay Pandavela nos anais do evento), ou seja, o mecanismo seria assim: NF1(-/-) → macrófagos → citocinas → CD8 células T → neurofibromas.
Lembrou que a mesma variante patogênica tem fenótipos diferentes por causa de genes diferentes e modificadores genéticos diferentes (epigenética). Sugeriu que esta informação poderá ser útil no tratamento dos plexiformes e que já há variantes germinativas ATM germline em estudo.
Finalmente, disse que um microambiente heterozigoto não é necessário para a formação de um neurofibroma plexiforme, ao contrário do que tem sido pensado nos últimos anos.
Preservação da audição nas pessoas com Schwannomatose relacionada ao gene NF2 (NF2-SWN)
De início, o palestrante Bradley Welling apresentou uma opinião controversa, a sua preferência em operar os schwannomas vestibulares o mais precocemente possível (quando ainda tem apenas milímetros de tamanho), pois a evolução a médio e longo prazo dos implantes cocleares e de tronco cerebral não é um resultado tão satisfatório.
(Comentário nosso: ver aqui nossa sugestão de tratamento para schwannomas vestibulares nas pessoas com NF2-SWN, na qual evitamos a abordagem cirúrgica o máximo possível)
Foi ressaltada a importância de se realizar a ressecção dos schwannomas com monitorização direta do nervo coclear para preservação da audição, mas não foram apresentados dados comparativos com esse desfecho entre procedimentos com ou sem monitoração.
Sobre os mecanismos para perda auditiva na swn-nf2, foram citados o comprometimento da vasculatura, a compressão direta da cóclea pelo tumor e a secreção de proteínas citotóxicas pelo tumor.
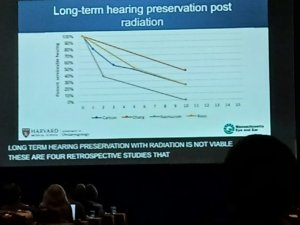
Relatou que 75% dos pacientes com NF2-SWN não são candidatos à cirurgia com preservação auditiva no momento da cirurgia. Dos 25% que se submetem à cirurgia, 70% têm tumores menores que 1cm, e metade deles evolui com preservação da audição no pós-operatório. Contudo, pela própria evolução da doença, a taxa de preservação da audição a longo prazo não tem melhora significativa.
A discrepância entre tamanho do schwannoma e perda auditiva foi novamente destacada, estando de acordo com o protocolo proposto pelo nosso CRNF (ver acima).
Alguns fatores intra-operatórios que determinam o resultado da cirurgia para a preservação da função auditiva:
- nervo de origem anatômica do tumor (ramo coclear, nervo vestibular superior ou inferior);
- suprimento vascular da cóclea;
- expertise do cirurgião;
- extensão do tumor;
- monitorização intra-operatória da função coclear (novamente sem dados apresentados);
Como tratamento paliativo para perda da audição na NF2-SWN, apresentaram os óculos de captura de fala em tempo real, nos quais a pessoa pode ler na lente as palavras ditas no ambiente em tempo real.
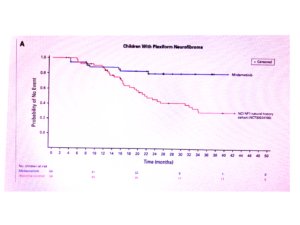
Concluiu com a apresentação de um gráfico (abaixo) sobre a preservação da função auditiva a longo prazo em diferentes trabalhos que avaliaram o efeito do tratamento dos schwannomas com radioterapia, todos de retrospectivos, mostrando que em todos os casos a audição teve piora progressiva, independente do efeito da radioterapia no tamanho do tumor.
Inteligência Artificial nas NF
Os três palestrantes do painel falaram sobre a IA e diagnósticos por imagem de tumores em oncologia, comentando as limitações para validação das ferramentos de IA, por parte dos pacientes e médicos, quanto ao seu uso na prática médica.
Existe uma IA, já disponível, que faz uma medida volumétrica em 3D dos schwannomas vestibulares na NF2-SWN. Foi questionada a capacidade de identificação pela IA de artefatos e para indicação do implante coclear.
Nos neurofibromas cutâneos ficou a impressão de que a IA teria utilidade, essencialmente, para medir a eficácia de intervenções terapêuticas.
Tratamento da transformação maligna dos neurofibromas
A Dra, Blakeley apresentou um estudo recém iniciado para tumor maligno da bainha do nervo periférico associando imunoterapia com quimioterapia com cirurgia e com radioterapia se cirurgia deixar margem com tumor.
As drogas em questão seriam:
- Nivolumabe + Ipilimumabe: imunoterapia para estudo histológico com resultado de tumor atípico ou TMBNP, cujo foco seriam PD-L1 e células T CD8 (CTLA4 e PD1);
- TMBNP recentemente diagnosticado por biópsia: 2 doses dos medicamentos nas 8 semanas entre a biópsia e o tratamento tradicional;
- Quimioterapia citotóxica pré cirurgia para melhorar as margens
- Cirurgia em busca de margem negativa.
- Se não conseguir margem negativa, radioterapia após a cirurgia.
Aguardaremos os resultados.
Análise do volume dos neurofibromas plexiformes
Este painel foi moderado por Andrea M Gross e Brigitte Widmann, ambas relacionadas aos estudos com Selumetinibe sob o patrocínio da Astrazeneca.
Foram lembradas as diversas características dos chamados neurofibromas plexiformes (de maneira generalizada), mas sem a proposta de separá-los para avaliação em nodulares, difusos e na forma espinhal.
Mostraram a diferença da medida em 1D, 2D e 3D, sendo a 3D mais precisa e, portanto, a indicada de acordo com as recomendações da “REINS Consensus Recommendation” para a medida dos neurofibromas plexiformes.
No painel mostrou-se que a definição do contorno pode ser: manual, semi automática ou por meio de IA, mas há limitações na definição de qual é o contorno para a medida do volume. A variabilidade de medida é grande entre observadores (tabela apresentada pela Eva Dombi).
Os diferentes tipos de neurofibromas plexiformes (sem distinção de difusos ou nodulares) foram mostrados como exemplos que são medidos com 3D e se apresentam para os estudos clínicos.
Foram discutidas as possibilidade sobre o que acontece quando um neurofibroma plexiforme “encolhe” com o tratamento (com iMEK, por exemplo):
- Remodelamento (a forma nodular se torna quase que o “resto” de um difuso) mas sem desaparecer;
- Mudança (diminuição) no sinal em T2 (até que ponto esta alteração modifica a definição do contorno e a medida pós iMEK? (dúvida nossa);
- Mudança na densidade do tumor.
Discutiu-se também se a precisão da medida 3D refletiria a realidade, pois há certo grau de incerteza, sendo dependente do examinador e como capta o processo de mudança. Diante disso, considerando os vieses na análise volumétrica, que uma diferença de 10% no volume deve ser considerada dentro de uma possível “margem de erro”.
Também se comentou sobre variação volumétrica e seu impacto estético: será que uma redução de 20% de volume pode representar pouco em relação a uma redução linear de um tumor (~6%)?
Nessa discussão, um dos participantes, Frank Buono (que é portador de NF2-SWN), ressaltou a relevância de se considerar a melhora dos sintomas em contraposição somente à redução do volume. Esta posição se opôs aos demais participantes do painel, envolvidos nos estudos com iMEK, que defenderam que uma diminuição de 20% no volume é um bom resultado.
Finalmente, foi debatida a relação entre a superfície dos tumores e o volume dos tumores, que pode ser extrapolada para os tumores plexiformes nodulares e difusos. Dois tumores com o mesmo volume podem ter superfícies muito diferentes (maior nos difusos), com diferente repercussão pela extensão do tumor, especialmente estética. Portanto, clinicamente, o impacto de uma pequena redução de volume (por ex, 20%) em um tumor plexiforme difuso, pode ser muito menor do que em um neurofibroma nodular.

A definição do contorno dos plexiformes sofre muitos vieses nos plexiformes difusos (mistura de tumor com tecidos sadios, estruturas normais com características de imagem semelhantes ao tumor, qualidade da imagem) impactando na variabilidade inter-examinadores.
AMANHÃ ENVIAREMOS MAIS NOTÍCIAS!!!