No quarto dia da Conferência do CTF em Washington (Estados Unidos), a Dra. Juliana Souza participou de painéis e palestras e nos traz os comentários dos participantes do evento sobre a sessão de posters onde ela apresentou outro trabalho científico desenvolvido em nosso CRNF (ver aqui nos anais do Congresso os resumos em inglês).
A seguir o resumo do nosso trabalho apresentado (em português).
Título
A terapia com inibidores de MEK pode ser descontinuada com segurança em um neurofibroma plexiforme responsivo? Um relato de caso
Souza JF (M.D., Ph.D.); Rezende NA (M.D., Ph.D.), Cota BCL (M.D., Ph.D.), Rodrigues LO (M.D., M.Sci.), Rodrigues LOC (M.D., Ph.D.). Centro de Referência Ambulatorial de Neurofibromatose (CRNF), Hospital das Clínicas (HC), Universidade Federal de Minas Gerais (UFMG), Brasil, rodrigues.loc@gmail.com
Introdução
O uso de inibidores de MEK (MEKi) tem sido recomendado para o tratamento de neurofibromas plexiformes sintomáticos inoperáveis (ISPN) em indivíduos com tipo de neurofibromatose (NF1) (1,2). Seguindo nosso protocolo de atendimento clínico para terapia MEKi no tratamento de ISPN (3), iniciamos o tratamento em um paciente do sexo masculino de 9 anos (DBF) com um extenso neurofibroma nodular em formato plexiforme afetando a pelve e o membro inferior direito (Figura 1A), acompanhado de dor neuropática intratável sem resposta à terapia anterior, incluindo imatinibe. O PET-CT pré-tratamento não mostrou transformação maligna. O acesso ao selumetinibe foi concedido por ordem judicial, e a terapia oral começou a ser de 25 mg/m² , duas vezes ao dia em ciclos de 28 dias a partir de dezembro de 2023.
Objetivo deste resumo
Explorar considerações clínicas sobre a descontinuação da terapia com selumetinibe, com foco no momento mais adequado, critérios e estratégias para interromper o tratamento com segurança sem causar crescimento tumoral ou recorrência da dor neuropática, seja devido à preferência do paciente ou limitações financeiras (4).
Métodos
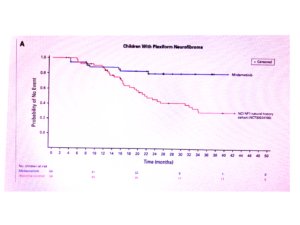
Os exames de ressonância magnética foram realizados a cada 6 meses, pois a análise volumétrica de ressonância magnética não estava disponível em nossa instituição. Os níveis de dor foram avaliados usando uma escala de dor padronizada e as medições da circunferência da coxa foram feitas antes e durante o tratamento (dezembro de 2023 a abril de 2025) (Ver gráfico abaixo).
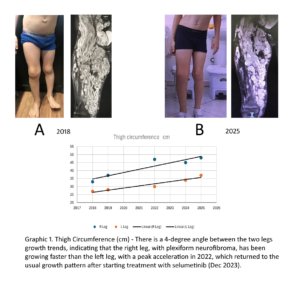
Figura 1 – Fotos dos membros inferiores de uma criança com NF1 acompanhada no CRNF por 8 anos, com ressonância magnética mostrando a extensão do neurofibroma nodular (do tipo plexiforme) e a evolução do perímetro das coxas ao longo dos anos, com e sem selumetinibe.
Resultados
Após 3 meses de tratamento, DBF relatou melhora significativa no controle da dor, uso de analgésicos não opioides de forma intermitente, e melhora na qualidade de vida, incluindo o retorno às atividades físicas na escola. Além disso, a família do paciente relatou uma percepção subjetiva de crescimento lento do ISPN, embora a ressonância magnética não tenha mostrado uma redução no tamanho do tumor (Figura 1B). O Gráfico 1 ilustra as mudanças na circunferência da coxa de 2018 a 2025. Em abril de 2025, as avaliações clínicas indicaram melhora sustentada da dor, qualidade de vida e diminuição da taxa de crescimento do tumor (Figura 1B), com eventos adversos mínimos relatados.
Conclusão
A avaliação clínica mais recente levou a uma avaliação entre a família do paciente e a equipe médica sobre os próximos passos do tratamento. Dado que o medicamento é aprovado pela FDA (e pela ANVISA no Brasil) sem protocolo prescrito para descontinuação quando as respostas ao tratamento são favoráveis, a questão de quando e como interromper a terapia permanece obscura.
Acreditamos que é hora de a comunidade NF se envolver em uma discussão completa sobre os resultados da interrupção da terapia MEKi para neurofibromas plexiformes. Esse diálogo é particularmente importante para apoiar melhor os indivíduos que podem não ser capazes de tolerar os efeitos colaterais, não podem pagar pelo tratamento ou preferem interromper a medicação.
Palavras-chave: neurofibromatose, neurofibromas plexiformes, inibidores de MEK, selumetinibe, cuidados clínicos Conflito de interesse: nenhum. Financiamento da AMANF – Associação Mineira de Apoio aos Portadores de Neurofibromatose
Referências
- Selumetinib in children with inoperable plexiform neurofibromas. Gross AM, Wolters PL, Dombi E, et al. N Engl J Med. 2020;382:1430–1442.
- Selumetinib in children with neurofibromatosis type 1 and asymptomatic inoperable plexiform neurofibroma at risk for developing tumor-related morbidity. Gross AM, Glassberg B, Wolters PL, et al. Neuro Oncol. 2022;24:1978–1988.
- Clinical Care Protocol to use selumetinib as a treatment for inoperable plexiform neurofibromas – a proposal. Rodrigues LO, Rezende NA, Cota BCL, et al. European Neurofibromatosis Meeting, 2020, Rotterdam. European Neurofibromatosis Meeting Abstracts & Presentations, 2020. https://amanf.org.br/atendimento-medico/selumetinibe/
- Challenges of selumetinib therapy for neurofibromatosis in a resource-limited setting. Khalaf T M, Alqadhi A A. 2025. Cureus 17(3): e81071.
Alguns dos comentários de participantes do evento que compareceram ao poster.
- Um médico falou sobre o que aconteceu quando ele interrompeu o uso do selumetinibe numa pessoa com glioma óptico (provavelmente uma paciente de algum estudo clínico) e houve a necessidade de trocar para a quimioterapia tradicional (no caso do glioma há esta opção, mas não nos neurofibromas): a paciente teve efeitos colaterais (dermatológicos) mais intensos após a puberdade (acne) com o selumetinibe e o glioma voltou a crescer com a interrupção da medicação.
- Outro médico, norte americano (que já trabalhou em Curitiba), conversou com colegas sobre o mesmo dilema enfrentado com um adolescente usando selumetinibe para um neurofibroma difuso mediastinal e mencionou uma proposta de redução progressiva da dose (desmame), evitando interrupção súbita. Ambos falaram de novo crescimento do tumor após a interrupção da medicação.
- A maior parte das pessoas compartilhou que este é um grande dilema que elas também têm enfrentado. Todas estão em busca de informações sobre o que acontece com a interrupção dos iMEK. Uma das médicas disse que o título do nosso pôster deveria ser “a questão de um milhão de dólares”.
- Houve relatos de pacientes, na maior parte adolescentes, que perguntam quanto tempo mais terão que usar o medicamento.
No geral, a percepção foi de que este tema é muito importante e está presente em diversos paineis, conferências e temas livres (posters) do evento.
AMANHÃ TRAREMOS A CONTINUAÇÃO DO RELATO DOS PAINEIS E CONFERÊNCIAS DA SEGUNDA FEIRA 23/06/25