Convido você a ver a live realizada pela Milena com a Maria Helena, um momento de reflexão calma e animadora sobre como enfrentar as dificuldades da NF1.
Clique abaixo.
Dr Lor
Convido você a ver a live realizada pela Milena com a Maria Helena, um momento de reflexão calma e animadora sobre como enfrentar as dificuldades da NF1.
Clique abaixo.
Dr Lor

Sabemos que as pessoas com NF1 podem passar mal no calor (ver aqui), por isso fiquei feliz em saber que o Sistema Único de Saúde está se preparando para enfrentar as mudanças no clima, inclusive as ondas de calor.
Antes de trabalhar com as neurofibromatoses, fui pesquisador durante vários anos na Universidade Federal de Minas Gerais, onde trabalhei com a adaptação humana ao calor, então pretendo contribuir com o esforço do Sistema Único de Saúde (SUS), no presente Governo Lula, para o enfrentamento dos impactos das ondas de calor sobre a saúde pública brasileira.
Por isso, preparei uma cartilha para profissionais da saúde e para familiares de pessoas com NF1.
Se desejar conhecer o que são as ondas de calor e como elas afetam a sua saúde, basta clicar aqui para ver o texto completo.
Selecionei do texto completo três informações sobre as ondas de calor que podem interessar a você.
1 – O que acontece quando o corpo aumenta muito a temperatura (chamamos de hipertermia) numa onda de calor?
Não confundir com FEBRE, veja aqui.
A figura abaixo mostra sinais e sintomas que podem ser moderados (menos de 40 graus centígrados de temperatura interna) ou graves (mais de 40 graus de temperatura interna).
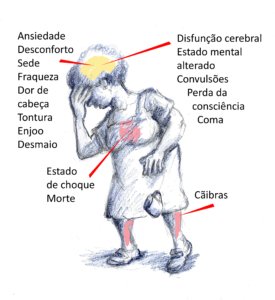
2 – Teste o seu risco
O quadro abaixo mostra um teste simples para conhecer seu risco de passar mal durante uma onda de calor.
| Condição | Sim |
| Mais de 60 anos ou menos de 10 anos | |
| Gênero feminino (dobrar pontuação se for gestante ou na menopausa) | |
| Obesidade (IMC maior que 30) | |
| Reside em região fria ou temperada | |
| Sedentarismo | |
| Mora em casa sem aparelho de ar-condicionado | |
| Possui doença cardiovascular, neurológica, renal, diabetes, câncer ou NF1 | |
| Usa algum medicamento para coração, para os rins ou neurológico | |
| Trabalha em ambiente quente e úmido ou sob o sol | |
| Já passou mal no calor (desmaio, náusea, confusão mental, “febre”, desidratação, pressão baixa) | |
| Total |
Em termos práticos, quanto maior a pontuação, maior o risco de uma pessoa apresentar hipertermia durante uma onda de calor, portanto, ela deve receber mais cuidados.
3 – E como tratar uma pessoa em estado de hipertermia durante uma onda de calor?
Os procedimentos básicos imediatos para tratamento de uma pessoa com suspeita de hipertermia moderada (temperatura interna menor que 40 graus centígrados) recomendadas pela medicina especializada em ambientes naturais, são:
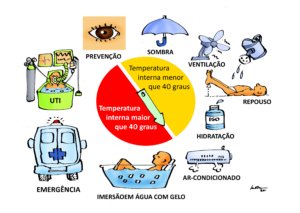
Remoção da pessoa do ambiente quente
Resfriamento natural e rápido com imersão na água fria ou molhando as roupas e promovendo ventilação
Medir a temperatura interna porque ela define se deve ou não ir para o hospital (ver abaixo comentário)
Hidratação oral
Repouso
Provavelmente estas medidas são suficientes para tratamento da hipertermia moderada, mas se houver mais recursos disponíveis, além das medidas acima, recomenda-se:
Remover a pessoa para ambiente com ar-condicionado (menor que 20 graus centígrados)
Resfriar o corpo o mais rápido que puder:
Imersão em água o mais fria possível (quanto mais rápido o resfriamento corporal, menor mortalidade e sequelas)
Se não puder ser feita a imersão, cobrir todo o corpo com compressas de gelo. Se não houver como fazer imersão ou colocar compressas de gelo, usar ventiladores sobre as roupas molhadas (menos eficiente)
Hidratar com líquidos isotônicos ou hipertônicos (para manter o volume sanguíneo e controlar as cãibras) e, se necessário, por via venosa (não há evidência de benefício em se usar infusão gelada)
Elevar as pernas e, se possível, colocar meias de compressão nas pernas para aumentar o retorno do sangue para o coração
Não usar aspirina, nem anti-inflamatórios ou outros antitérmicos!
Nota importante: como medir a temperatura interna?
A medida mais prática da temperatura interna é a medida da temperatura retal. Alternativamente, pode-se usar a temperatura timpânica ou esofagiana. Em último caso, a temperatura axilar pode ser usada, mas sabendo-se que ela pode não refletir exatamente a temperatura interna.
A medida da temperatura interna é um desafio que as equipes de saúde precisam enfrentar daqui em diante, pois há alguns anos, num estudo que fizemos em dois grandes Hospitais de Pronto Socorro em Belo Horizonte, nem mesmo a temperatura axilar era medida rotineiramente no atendimento inicial. O SUS precisa incluir esta norma em suas orientações para enfrentar as ondas de calor.
Na suspeita de hipertermia grave (temperatura interna maior que 40 graus centígrados e/ou outros sintomas graves), usar todos os recursos anteriores enquanto se transfere a pessoa para um hospital de emergências e além das medidas acima, acrescentar:
Suporte ventilatório (com oxigênio)
Suporte cardíaco (com monitorização eletrocardiográfica para detectar arritmias e da pressão arterial)
Medida da temperatura retal (ou timpânica) (maior que 40 graus confirma a gravidade)
Monitorar o volume e a cor da urina para avaliar o estado de hidratação
No hospital deve receber cuidados intensivos porque podem desenvolver as seguintes complicações:
Estado de choque com falência múltipla de órgãos
Encefalopatia (tremores, confusão mental e agressividade durante resfriamento rápido)
Insuficiência respiratória
Lesão hepática e renal agudas
Rabdomiólise (lesão muscular grave)
Coagulação intravascular disseminada
Isquemia intestinal com septicemia
Os detalhes do tratamento intensivo fogem ao objetivo deste texto, mas todas as medidas terapêuticas devem ser tomadas enquanto se continua o resfriamento do paciente. Até a temperatura interna (retal) atingir 38,3 a 38,8 graus centígrados, o resfriamento ativo deve ser mantido (ver detalhes aqui).
As equipes de emergência precisam criar condições técnicas (salas especiais e ambientes adaptados) que permitam o resfriamento por imersão em água gelada enquanto outros procedimentos são realizados.
A equipe médica deve também fazer o diagnóstico diferencial com: hipoglicemia, epilepsia, doença do sistema nervoso central, hiponatremia, hipernatremia, edema cerebral de alta altitude, infecção grave, alteração endócrina grave e ingestão de drogas.
Veja mais informações no texto completo AQUI.
Portanto, cuidemos da vida.
Dr Lor
A maioria das famílias tem dificuldade em falar sobre uma doença genética na família. Muitas vezes os pais protelam por anos o momento de explicar para a própria criança as causas de suas manchas, de sua dificuldade de aprendizado, dos exames médicos e outros acontecimentos na sua vida que a tornam diferente das demais crianças.
Este é um dos assuntos abordados na excelente live no canal Enfermeira Rara realizada pela enfermeira Milena Silva (portadora de NF1) com a médica Maria Carolina Melo Feitosa (mãe de uma menina com NF1) e coordenadora do grupo de WhatsApp Ninguém Fica de Fora.
Vale a pena assistir!
Abraços
Dr Lor
Clique no link para ver a gravação da live:

Ontem lançamos um pedido de ajuda para a realização de para um exame caro (PET CT) para um paciente do Centro de Referência em Neurofibromatoses do Hospital das Clínicas da UFMG, que precisa do exame para ser operado com urgência por causa de transformação maligna de um neurofibroma.
Em poucas horas, a generosidade de 31 pessoas completou o valor necessário, garantindo assim as condições para a cirurgia ser realizada em breve.
Assim, queremos agradecer a todas as pessoas que contribuíram com este gesto de solidariedade.
Muito obrigado!
Diretoria da AMANF

Uma revisão científica recente (ver aqui artigo completo) trouxe informações sobre muitos estudos em andamento, mostrando os avanços no tratamento da NF1 realizados em todo o mundo.
Considero essa revisão completa e por isso adaptei abaixo as principais conclusões do estudo, desejando que em 2026 mais resultados sejam obtidos para que possamos melhorar nosso atendimento às pessoas com NF.
Vamos renovar nossas esperanças!
Dr. Lor
A NF1 tem sido e continua sendo uma doença genética desafiadora por causa da complexidade do gene e dos mecanismos da doença, que levam a manifestações clínicas variáveis, com alta taxa de casos novos.
Os recentes avanços na compreensão da estrutura complexa do gene NF1 e da arquitetura e funções da proteína neurofibromina inspiraram novo desenvolvimento para tratamentos mais direcionados.
As novas abordagens terapêuticas concentram-se principalmente na terapia de inibição de vias metabólicas intracelulares (em especial a via MEK), com algumas drogas já aprovadas para uso clínico, como selumetinibe e mirdametinibe, que acrescentaram nova opção ao tratamento cirúrgico tradicional da NF1.
Os inibidores MEK (iMEK) não são curativos e podem apenas estabilizar a progressão tumoral, portanto outros métodos terapêuticos são necessários para outras manifestações da NF1, especialmente para a prevenção, o controle e a cura de tumores malignos associados à NF1.
A terapia gênica, ou seja, corrigir o defeito genético no próprio DNA, promete mudanças mais fundamentais para restaurar a neurofibromina funcional.
O uso de alguns vírus (como o adenovírus), que já é uma ferramenta de tratamento genético seguro e amplamente utilizado, tem sido amplamente explorado na terapia gênica da NF1 recentemente.
Devido ao fato do gene NF1 ser muito grande e exceder a capacidade de carga de um único vírus, as pesquisas atuais priorizam a correção de partes funcionais do gene (domínios), especialmente os denominados GRD.
Além disso, a engenharia do uso de vírus é aplicada para melhorar a afinidade de drogas a serem entregues nas células de Schwann (que são a origem dos neurofibromas), reduzir a toxicidade fora do alvo e aumentar o efeito terapêutico. Esse tipo de entrega de parte do gene NF1 funcionou bem em estudos pré-clínicos em vários modelos de NF1 e oferece potencial para avançar o desenvolvimento de medicamentos. Parece um campo promissor para terapia futura, então a validação pré-clínica e os ensaios clínicos adicionais são necessários para aplicações mais amplas.
Outros métodos terapêuticos emergentes, como vírus que atacam células cancerosas, também oferecem ferramentas promissoras para terapia direcionada. Alguns já foram aprovados para tratamentos, como para o melanoma, mas ensaios clínicos adicionais são urgentemente necessários para a expansão do seu uso na NF1.
Outras estratégias celulares e de pequenas moléculas para NF1, incluindo uma terapia com células chamadas CAR-T e terapia de inibição molecular, também estão sendo investigadas. Embora a terapia com células CAR-T enfrente desafios devido à barreira de aplicação em tumores sólidos, especialmente naqueles tumores sólidos da NF1, ela apresenta potencial para ganhar preferência no tratamento da NF1 por meio de administração sistêmica e não apresenta a preocupação com anticorpos antivirais, ao contrário do uso de vírus.
Em resumo, estão sendo amplamente estudadas as vias de sinalização intracelulares relacionadas à NF1, além dos inibidores de MEK, buscando terapias com pequenas moléculas para atuarem em determinadas vias e reguladores epigenéticos relacionados à NF1. Para futuras transformações em medicamentos, a toxicidade e a resistência requerem validação adicional em ambientes pré-clínicos e clínicos.
Cada estratégia terapêutica emergente para NF1 apresenta pontos fortes e limitações distintas:
Em conjunto, vemos o potencial de terapias combinadas racionais entre os métodos terapêuticos mencionados acima, por exemplo, combinando a terapia gênica com vírus com um inibidor de MEK ou com a terapia com o HSV para melhorar a eficácia terapêutica.
No entanto, essas terapias combinadas também requerem mais validação pré-clínica e clínica para aprimorar os efeitos terapêuticos.
No futuro, a integração dessas terapias avançadas na prática clínica poderá tratar mais pacientes com NF1 com diversas manifestações da doença e curar ou controlar a progressão de tumores malignos associados à NF1.
Quando chegarmos lá, haverá tratamentos mais personalizados, eficazes e seguros, que levarão a uma sobrevida prolongada e melhor qualidade de vida para todos os pacientes com NF1.


Tenho a satisfação de receber no nosso blog uma pessoa que está sendo conhecida na comunidade NF pelo seu excelente trabalho de divulgação científica e humanitária sobre as NF no canal Enfermeira Rara, do qual tive a oportunidade de participar ontem (ver abaixo).
Com a palavra, Milena!
Dr Lor
Olá! Sou a Milena, enfermeira, tenho Neurofibromatose tipo 1, motivo da minha pesquisa de mestrado, sou mestre em Psicologia da Saúde, além de autora do livro “Neurofibromatose: Mapeamento de Associações, Instituições e Serviços Existentes no Brasil”.
Sou natural de Votuporanga, interior de São Paulo, e atuo há mais de 10 anos na área da Saúde Mental, trabalhando em um CAPS II. Posso dizer que, além da minha paixão pela psiquiatria, também me descobri encantada pelo universo da genética.
Durante minha participação em grupos de WhatsApp, percebi a grande necessidade de levar informações baseadas em ciência, com o apoio de profissionais renomados no assunto, para um público mais amplo.
Foi então que enxerguei a oportunidade de usar a internet como ferramenta de divulgação* e de apoio às pessoas que convivem com a Neurofibromatose, uma doença rara e ainda pouco conhecida — inclusive entre profissionais da saúde.
Em uma conversa com um amigo de trabalho, surgiu a ideia de criar um canal no YouTube, e assim nasceu o meu “xodó”: o canal *Enfermeira Rara*, um espaço criado com muito carinho para compartilhar conhecimento, histórias reais e experiências transformadoras.
No meu canal você vai encontrar lives com especialistas, depoimentos pessoais e conteúdos educativos sobre o universo das doenças raras.
Meu objetivo é informar, acolher e conectar pessoas — pacientes, familiares e profissionais — que desejam aprender mais sobre essa causa.
Lá, conversamos sobre Neurofibromatose de forma leve, acessível e embasada, compartilhando informações, histórias de vida, depoimentos e lives com profissionais de excelência que dominam o tema.
Tem sido uma experiência incrível! O canal me proporcionou conhecer pessoas maravilhosas, dispostas a fortalecer essa rede, e profissionais comprometidos* em divulgar conhecimento de qualidade.
Se você ainda não conhece, *corre lá e se inscreva*! LINK
Você vai encontrar vídeos com meus depoimentos pessoal, além de todas as lives gravadas, repletas de conteúdo e aprendizado.
Aproveito para agradecer a todos os profissionais que aceitaram o meu convite até aqui, ao apoio da minha família e, especialmente, ao John, que está por trás das câmeras tornando tudo isso possível.
Com carinho,
Rosângela Milena da Silva
Enfermeira Rara
Veja a live de ontem

Tenho recebido frequentemente perguntas sobre se as pessoas com NF1 podem se submeter a alguns procedimentos como acupuntura, quiropraxia e osteopatia para tratamento de dores.
Não conheço (ainda) nenhum estudo cientificamente bem conduzido que possa me permitir uma resposta segura se elas podem ou não afetar a saúde das pessoas com NF1.
Assim, o que posso sugerir é cautela, porque estes métodos apresentam eficácia questionável para tratamento da dor, mesmo nas pessoas SEM NF1.
Da mesma forma, outros procedimentos estéticos como tatuagem, injeção botulínica (Botox) e depilação a laser, também não possuem estudos científicos sobre seus riscos em pessoas com NF1.
Portanto, minha sugestão geral é: evitar até que tenhamos informações científicas seguras.
Dr Lor

Temos a satisfação de apresentar a todas as pessoas que têm contribuído financeiramente com a AMANF as nossas contas dos últimos 12 meses.
Somos gratos a todas as contribuições realizadas, não importa o valor, pois cada uma delas contribuiu em:
Graças à solidariedade de tantas pessoas, temos conseguido sustentar nossas ações básicas e apoiar pessoas com NF e seus familiares, mas a expansão de nossas atividades depende de novos recursos.
Por exemplo, planejamos para o próximo ano:
Por isso, sua contribuição é e sempre será fundamental para que possamos continuar nosso trabalho solidário.
SOMOS MUITAS PESSOAS, MAS VOCÊ É INDISPENSÁVEL!

A AMANF tem a satisfação de apresentar o trabalho do Daniel Maier dos Santos, estudante de Biomedicina na Unisinos no Rio Grande do Sul, que viajou até São Paulo para apresentar seu trabalho de pesquisa no encontro científico chamado Simpósio Next Frontiers do AC Camargo (https://accamargo.org.br/
Daniel, que tem um irmão com NF1 (clique para saber mais dessa história de amor fraterno), fez uma vaquinha (da qual a AMANF fez parte) para poder viajar até São Paulo e participou de uma mesa redonda (clique aqui para ver).
O interesse de estudantes pelas NFs (NF1, e Schwannomatoses) é a nossa esperança de um dia podermos descobrir a cura (ver aqui mais informações sobre a busca do Daniel pela cura do irmão) e cuidarmos cada vez melhor das pessoas com NFs.
Parabéns, Daniel, e conte com nosso apoio para suas novas jornadas.
Dr Lor