Uma revisão científica recente (ver aqui artigo completo) trouxe informações sobre muitos estudos em andamento, mostrando os avanços no tratamento da NF1 realizados em todo o mundo.
Considero essa revisão completa e por isso adaptei abaixo as principais conclusões do estudo, desejando que em 2026 mais resultados sejam obtidos para que possamos melhorar nosso atendimento às pessoas com NF.
Vamos renovar nossas esperanças!
Dr. Lor
A NF1 tem sido e continua sendo uma doença genética desafiadora por causa da complexidade do gene e dos mecanismos da doença, que levam a manifestações clínicas variáveis, com alta taxa de casos novos.
Os recentes avanços na compreensão da estrutura complexa do gene NF1 e da arquitetura e funções da proteína neurofibromina inspiraram novo desenvolvimento para tratamentos mais direcionados.
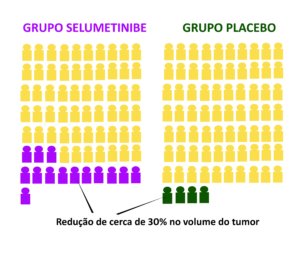
As novas abordagens terapêuticas concentram-se principalmente na terapia de inibição de vias metabólicas intracelulares (em especial a via MEK), com algumas drogas já aprovadas para uso clínico, como selumetinibe e mirdametinibe, que acrescentaram nova opção ao tratamento cirúrgico tradicional da NF1.
Os inibidores MEK (iMEK) não são curativos e podem apenas estabilizar a progressão tumoral, portanto outros métodos terapêuticos são necessários para outras manifestações da NF1, especialmente para a prevenção, o controle e a cura de tumores malignos associados à NF1.
A terapia gênica, ou seja, corrigir o defeito genético no próprio DNA, promete mudanças mais fundamentais para restaurar a neurofibromina funcional.
O uso de alguns vírus (como o adenovírus), que já é uma ferramenta de tratamento genético seguro e amplamente utilizado, tem sido amplamente explorado na terapia gênica da NF1 recentemente.
Devido ao fato do gene NF1 ser muito grande e exceder a capacidade de carga de um único vírus, as pesquisas atuais priorizam a correção de partes funcionais do gene (domínios), especialmente os denominados GRD.
Além disso, a engenharia do uso de vírus é aplicada para melhorar a afinidade de drogas a serem entregues nas células de Schwann (que são a origem dos neurofibromas), reduzir a toxicidade fora do alvo e aumentar o efeito terapêutico. Esse tipo de entrega de parte do gene NF1 funcionou bem em estudos pré-clínicos em vários modelos de NF1 e oferece potencial para avançar o desenvolvimento de medicamentos. Parece um campo promissor para terapia futura, então a validação pré-clínica e os ensaios clínicos adicionais são necessários para aplicações mais amplas.
Outros métodos terapêuticos emergentes, como vírus que atacam células cancerosas, também oferecem ferramentas promissoras para terapia direcionada. Alguns já foram aprovados para tratamentos, como para o melanoma, mas ensaios clínicos adicionais são urgentemente necessários para a expansão do seu uso na NF1.
Outras estratégias celulares e de pequenas moléculas para NF1, incluindo uma terapia com células chamadas CAR-T e terapia de inibição molecular, também estão sendo investigadas. Embora a terapia com células CAR-T enfrente desafios devido à barreira de aplicação em tumores sólidos, especialmente naqueles tumores sólidos da NF1, ela apresenta potencial para ganhar preferência no tratamento da NF1 por meio de administração sistêmica e não apresenta a preocupação com anticorpos antivirais, ao contrário do uso de vírus.
Em resumo, estão sendo amplamente estudadas as vias de sinalização intracelulares relacionadas à NF1, além dos inibidores de MEK, buscando terapias com pequenas moléculas para atuarem em determinadas vias e reguladores epigenéticos relacionados à NF1. Para futuras transformações em medicamentos, a toxicidade e a resistência requerem validação adicional em ambientes pré-clínicos e clínicos.
Cada estratégia terapêutica emergente para NF1 apresenta pontos fortes e limitações distintas:
- Abordagens de terapia gênica, como a substituição do gene NF1mediada por vírus visam restaurar o defeito genético, mas enfrentam desafios relacionados com:
- capacidade limitada de carga dos vírus,
- pouca sua afinidade do vírus com as células que desejamos tratar,
- imunidade preexistente
- segurança a longo prazo.
- O HSV oncolítico depende da permissividade intrínseca do tumor e frequentemente requer injeção local, o que restringe a distribuição sistêmica e limita o acesso a lesões profundas.
- A terapia com células CAR-T enfrenta desafios como heterogeneidade antigênica, infiltração limitada de células T em tumores sólidos e efeitos fora do alvo.
- Inibidores de pequenas moléculas direcionados a RAS, PAM, RTKs, JAK/STAT ou reguladores epigenéticos frequentemente produzem apenas respostas parciais como monoterapia e são limitados por toxicidades sistêmicas.
Em conjunto, vemos o potencial de terapias combinadas racionais entre os métodos terapêuticos mencionados acima, por exemplo, combinando a terapia gênica com vírus com um inibidor de MEK ou com a terapia com o HSV para melhorar a eficácia terapêutica.
No entanto, essas terapias combinadas também requerem mais validação pré-clínica e clínica para aprimorar os efeitos terapêuticos.
No futuro, a integração dessas terapias avançadas na prática clínica poderá tratar mais pacientes com NF1 com diversas manifestações da doença e curar ou controlar a progressão de tumores malignos associados à NF1.
Quando chegarmos lá, haverá tratamentos mais personalizados, eficazes e seguros, que levarão a uma sobrevida prolongada e melhor qualidade de vida para todos os pacientes com NF1.