


Um estudo científico bem conduzido na Austrália pelo grupo da Dra. Kathryn N. North avaliou o comportamento de crianças e adolescentes com neurofibromatose do tipo 1 (NF1), transtorno no espectro do autismo (TEA) e transtorno de déficit de atenção e hiperatividade (TDAH) e observou que estas 3 condições apresentam em comum o chamado transtorno do processamento sensorial (TPS) (ver aqui artigo completo em inglês).
Este texto recebeu a leitura e sugestões da Fernanda Siqueira (neuropsicopedagoga) e do Nilton Alves de Rezende (professor de medicina da UFMG).
Que ele seja útil à nossa comunidade NF!
Dr. Lor
Introdução
Para compreendermos bem o artigo australiano, precisamos lembrar como os estímulos (luz, som, calor, vibração etc) são percebidos pelos sensores do corpo (nervos nos olhos, orelhas, pele, músculos etc) para que sejam processados no cérebro de forma adequada para criar comportamentos que permitam a vida.
Como os estímulos são percebidos?
Para um estímulo qualquer ser percebido, ele precisa atingir um sensor (ou receptor) que seja sensível a ele. Por exemplo, a retina tem sensores para a luz, mas a pele não. Ao contrário, a pele tem sensores para o calor, mas a retina, não.
Quanto mais forte o estímulo, por exemplo, um som mais alto, mais ele ativa o sensor correspondente, no caso do som o sistema auditivo, que transmite um sinal para o cérebro, onde ele é processado (ver abaixo) para gerar uma resposta comportamental adequada àquele som.
Por outro lado, quanto mais sensível for um sensor, mais intensamente ele perceberá o estímulo. Por exemplo, um sistema auditivo mais sensível perceberá até os sons mais baixos e sutis.
A sensibilidade de cada sensor ao seu estímulo específico pode variar de acordo com a frequência com que o sensor está sendo estimulado. Quanto mais “novidade” for um estímulo, maior a sensibilidade do sensor. Quanto mais repetido for o estímulo, menor a sensibilidade do sensor.
A sensibilidade do sensor num certo momento é chamada de limiar de sensibilidade.
A medida do limiar da sensibilidade é a intensidade necessária para o estímulo ser percebido. Um limiar baixo significa que um pequeno estímulo ativa o sensor; um limiar alto significa que é preciso um estímulo mais forte para ativar o sensor.
Em resumo, quanto mais baixo o limiar, menor será o estímulo necessário para a criança sentir e reagir a ele (fenômeno chamado de sensibilização).
Quanto mais alto o limiar, maior será o estímulo necessário para a criança sentir e reagir a ele (fenômeno chamado de habituação).
Crianças com limiares sensoriais baixos são facilmente estimuladas por coisas que geralmente não incomodam as crianças neurotípicas. Por exemplo, crianças com NF1 podem ter maior sensibilidade tátil e por isso evitar andar descalças na grama ou areia ou expressar desconforto ou dor quando alguém escova seu cabelo.
Crianças com limiares sensoriais altos apresentam dificuldade para serem estimuladas por coisas que geralmente são percebidas pelas crianças neurotípicas. Por exemplo, crianças com NF1 podem demorar para perceber que estão chamando pelo seu nome ou não ter consciência do toque de outra pessoa, a menos que seja mais intenso.
O que é o processamento sensorial?
O processamento sensorial é a capacidade do sistema nervoso de detectar, integrar, modular e interpretar todas as informações captadas pelos diversos sensores que foram ativados pelos estímulos que nos chegam do ambiente e do nosso próprio corpo. As informações sensoriais processadas no sistema nervoso central, que permitem nossa adaptação ao ambiente, são:
A integração de todas estas informações sensoriais é que nos permite reagir adequadamente às variações internas e do ambiente. Elas são utilizadas pelo sistema nervoso para que possamos perceber de forma contínua o nosso próprio corpo num determinado ambiente físico, assim como os indicadores e regras sociais para que nosso comportamento seja adequado a cada momento, em cada grupo de pessoas ou numa sociedade.
O que é o transtorno de processamento sensorial?
Quando as informações sensoriais são percebidas para mais ou para menos do que deveriam ser, a sua integração no sistema nervoso pode se tornar incorreta, gerando respostas comportamentais inadequadas, que são os Transtornos do Processamento Sensorial (TPS).
O estudo australiano mostrou que estes estímulos sensoriais podem ser percebidos em intensidades incorretas nas crianças com NF1, TDAH e TEA:
A resposta comportamental aos estímulos sensoriais também pode variar nas as crianças com NF1, TDAH e TEA:
Cada criança com TPS apresenta comportamentos que misturam as características descritas acima. Por exemplo, uma criança pode ser muito sensível aos estímulos auditivos e reagir passivamente a eles com grande ansiedade, mas, ao mesmo tempo, ser pouco sensível aos estímulos táteis e reagir ativamente a eles procurando o contato com pessoas ou objetos frequentemente.
Ao contrário, outra criança pode ser pouco sensível aos estímulos auditivos e reagir ativamente buscando estímulos sonoros e fazendo barulho o tempo todo, mas, ao mesmo tempo, ser muito sensível aos estímulos táteis e reagir ativamente a eles evitando o contato com outras pessoas, certos tipos de roupas ou calçados.
O estudo australiano mediu o processamento sensorial auditivo, tátil, visual, oral, da posição corporal e do movimento nas crianças com NF1, TEA e TDAH e comparou com crianças neurotípicas. O resultado do estudo mostrou que o TPS foi observado em cerca de 60% das crianças com NF1, TEA e TDAH.
Sensibilidade aos estímulos e resposta comportamental
Podemos incorporar as definições anteriores num quadro que combina o nível de sensibilidade para determinado estímulo (para mais ou para menos) com a reação comportamental da criança (ativa ou passiva).
É o chamado Modelo de Quatro Quadrantes de Processamento Sensorial de Dunn. Este modelo, que se baseia em dados comportamentais e neurocientíficos, propõe que as crianças têm limiares neurais únicos para responder a informações sensoriais, que, por sua vez, afetam a forma como elas respondem ao seu ambiente cotidiano.
Respostas ativas ou passivas
A resposta de uma criança a um estímulo sensorial pode ser por meio de um comportamento ativo – agindo para aumentar ou reduzir o estímulo, – ou por meio de um comportamento passivo – ignorando o estímulo ou reagindo apenas internamente.
Combinando os limiares altos e baixos com as respostas ativas e passivas, temos o Modelo de Quatro Quadrantes de Processamento Sensorial de Dunn (abaixo).
| Baixa sensibilidade
(limiar alto) |
Alta sensibilidade
(limiar baixo) |
|
| Reação ativa
tenta controlar o estímulo |
A | B |
| Reação passiva
ignora o estímulo ou reage internamente |
C | D |
Exemplos de uso do quadro (aqui apenas com estímulos auditivos, mas poderiam ser quaisquer outras modalidades de estímulos sensoriais):
No tipo A, seria uma criança que percebe pouco os estímulos sonoros e reage ativamente aumentando o som ou produzindo barulhos.
No tipo B, seria uma criança que percebe muito os estímulos sonoros e reage ativamente com redução do som, fuga, aversão ou tampando as orelhas.
No tipo C, seria uma criança que percebe pouco os estímulos sonoros e reage passivamente, sem resposta.
No tipo D, seria uma criança que percebe muito os estímulos sonoros e reage passivamente com manifestações internas de ansiedade e mal-estar.
Uma mesma criança com NF1 pode ser, por exemplo, do tipo A para estímulos sonoros, mas ser do tipo C para estímulos visuais.
Assim, o transtorno no processamento sensorial pode afetar significativamente a forma como uma criança responde e funciona em seu ambiente, resultando em comportamentos desafiadores, ansiedade, poucas habilidades adaptativas, poucas interações sociais, atraso no desenvolvimento da linguagem, redução no desempenho motor e acadêmico.
Esse impacto é exemplificado em indivíduos com TEA, que apresentam respostas atípicas a estímulos sensoriais em mais de 70% das crianças. As diferenças de processamento em crianças com TEA são relatadas em todas as modalidades sensoriais, incluindo domínios táteis, visuais e auditivos, com hipo e hiper-responsividade relatadas. Essas diferenças podem ter um impacto considerável nas interações sociais e no funcionamento do dia-a-dia. A hipersensibilidade ou hipossensibilidade a estímulos sensoriais é considerada um sintoma central do autismo, conforme conceituado pelo Manual Diagnóstico e Estatístico de Transtornos Mentais 5ª Edição – Revisão de Texto (DSM-5-TR), com alguns estudos sugerindo dificuldades de processamento sensorial, como hiper-responsividade ao som ou toque, podem estar entre os primeiros indicadores de TEA.
O estudo australiano
Depois da introdução acima, podemos retomar o estudo realizado pela equipe da Dra. Kathrin North. Apesar de haver outras modalidades de informações sensoriais, o estudo avaliou especificamente as auditivas, visuais, táteis, relacionadas ao movimento, posição corporal e orais (tato, paladar e olfato). Traduzimos e adaptamos algumas das partes do estudo, aquelas que nos pareceram mais úteis às pessoas leitoras sem formação biológica.
Em resumo, a equipe partiu da verificação que as dificuldades no processamento sensorial são freqüentemente encontradas em distúrbios do neurodesenvolvimento e podem afetar significativamente a forma como uma criança responde e funciona em seu ambiente. Porém, os estudos que examinam o processamento sensorial em crianças com neurofibromatose tipo 1 (NF1) são escassos. Então, o estudo examinou o processamento sensorial relatado pelos pais em uma amostra de 152 crianças com NF1.
Este estudo foi concebido para caracterizar o perfil de processamento sensorial de crianças com NF1. Abordamos três objetivos principais neste estudo:
(i) examinar a proporção de indivíduos com NF1 exibindo respostas incomuns a estímulos sensoriais em comparação com crianças com desenvolvimento típico (DT);
(ii) examinar o processamento sensorial, incluindo estilos e modalidades de resposta, de crianças com NF1 em comparação com um grupo controle de DT; e
(iii) examinar a associação entre características de processamento sensorial e idade, sexo e medidas dimensionais quantitativas de funcionamento intelectual, comportamentos autistas, sintomas de TDAH, sintomas internalizantes, habilidades sociais e funcionamento adaptativo.
Os pais/cuidadores de 152 crianças com NF1 e 96 crianças com desenvolvimento típico preencheram um questionário chamado Perfil Sensorial 2 (SP2), juntamente com questionários padronizados avaliando comportamentos autistas, sintomas de TDAH, sintomas internalizantes, funcionamento adaptativo e habilidades sociais. O funcionamento intelectual também foi avaliado.
O Perfil Sensorial 2 (SP2) [2] é um questionário de 86 itens para pais/cuidadores projetado para avaliar a função sensorial. Os itens são medidos em uma escala de 5 pontos que varia de “quase sempre” a “quase nunca”. O SP2 fornece um perfil sensorial de quatro quadrantes (de Dunn, ver acima): busca sensorial, hipersensibilidade, evitação sensorial e baixo registro.
Os dados do SP2 indicaram importantes problemas de processamento sensorial em crianças com NF1 em comparação com crianças com desenvolvimento típico. Mais de 40% das crianças com NF1 apresentaram diferenças no registro sensorial (falta de entrada sensorial) e foram incomumente sensíveis e evitativas a estímulos sensoriais.
Aproximadamente 61% das crianças com NF1 apresentaram diferenças na forma como respondem a estímulos sensoriais quando comparadas a um grupo controle com desenvolvimento típico (Figura 1).Essas dificuldades foram observadas igualmente em todas as idades e sexo e foram associadas a um maior grau de comportamentos autistas, sintomas de TDAH, habilidades adaptativas mais baixas, habilidades sociais mais pobres e aumento da ansiedade e sintomas afetivos.
Figura 1. Porcentagem de NF1 e participantes de controle com desenvolvimento típico que excedem a faixa normal no SP2. Seeking busca ativa (Tipo A); Avoidance : evitação ativa (Tipo C); Hypersensitive: limiar baixo (Tipo D); Registration: limiar alto (Tipo B); Colunas cinza: transtornos mais presentes do que nas outras crianças; Colunas pretas: transtorno muito mais presente do que nas outras crianças.
Estes resultados destacam a importância de enfrentarmos as dificuldades de processamento multissensorial em casa e na escola ao decidirmos como apoiar uma criança com NF1 em todos os ambientes.
Discussão
Embora normalmente classificada como uma síndrome de predisposição tumoral, as complicações mais comuns em crianças com NF1 são dificuldades com o funcionamento social, comportamental, acadêmico e cognitivo. Aproximadamente 30-50% das crianças com NF1 atendem aos critérios para transtorno de déficit de atenção e hiperatividade (TDAH), até metade exibe comportamentos autistas e aproximadamente 25% atendem aos critérios diagnósticos para autismo, todos associados a dificuldades de processamento sensorial.
Apesar da alta prevalência dessas dificuldades de neurodesenvolvimento, os estudos que examinam o processamento sensorial em crianças com NF1 são escassos. As evidências recentes sugerem diferenças na forma como os bebês com NF1 processam informações auditivas, o que tem sido associado ao surgimento posterior de traços autistas. Alterações no processamento auditivo, incluindo a percepção das características temporais de um som, também foram detectadas em crianças com NF1, com algumas encontrando uma relação entre essas diferenças e funções, incluindo o grau de comprometimento da linguagem e distúrbio de comunicação e processamento fonológico.
Embora o estudo de sistemas sensoriais isolados (som ou visão ou tato etc.) dentro de uma condição genética forneça conhecimento valioso, a integração multissensorial é necessária para muitas funções, incluindo comunicação e linguagem.
Aumentar a conscientização não apenas sobre a gama de modalidades afetadas na NF1, mas também sobre o perfil sensorial e as respostas comportamentais relacionadas aos sentidos, será importante para informar e identificar intervenções sensoriais eficazes para crianças com NF1.
Este é o primeiro estudo a apresentar o perfil dos comportamentos em relação aos estímulos sensoriais em crianças com NF1 e sua associação com as características e funcionamento da criança.
Com exceção da modalidade visual, as crianças com NF1 apresentaram níveis mais altos de respostas incomuns a estímulos sensoriais em todas as dimensões de responsividade e modalidades sensoriais do que os controles DT.
Os tamanhos de efeito foram moderados a grandes. Essas dificuldades foram observadas igualmente em toda a faixa etária do estudo (3 a 15 anos) e em ambos os sexos. O risco relativo de desenvolver problemas de processamento sensorial foi de 3 a 9,6 vezes maior para crianças com NF1 em comparação com os controles DT, com hipersensibilidade considerada o maior risco, seguida por baixo registro, evitação sensorial e busca sensorial. Aproximadamente 61% das crianças com NF1 tiveram uma ou mais modalidades impactadas, com dificuldades comumente ocorrendo em várias modalidades e em várias áreas de responsividade.
Esses resultados sugerem que, se uma criança com NF1 tiver desafios de processamento sensorial, é provável que eles ocorram em várias áreas do processamento sensorial.
Eles podem ser sensoriais em busca de estímulos, ter baixo registro, evitar estímulos sensoriais e, ao mesmo tempo, ser hipersensíveis a estímulos sensoriais, pois esses padrões não são mutuamente exclusivos Por exemplo, uma criança com NF1 pode buscar entrada tátil brincando com materiais texturizados, mas, ao mesmo tempo, ter dificuldade em registrar certos sons. A mesma criança também pode evitar texturas específicas, como certas roupas, e ser sensível a ruídos altos.
Ao considerar como apoiar efetivamente as crianças com NF1, médicos, pais/cuidadores e educadores devem levar em consideração o processamento multissensorial e observar que o padrão de processamento sensorial de cada criança é único e pode variar em diferentes situações.
Observamos uma relação moderada a forte entre os escores SP2 e comportamentos autistas e sintomas de TDAH no estudo atual. Isso demonstra que crianças com NF1 que apresentam dificuldades de processamento sensorial também são mais propensas a exibir comportamentos autistas e sintomas de TDAH e sugere que as dificuldades de processamento sensorial são uma parte importante do fenótipo de neurodesenvolvimento da NF1.
Os resultados também demonstram um perfil de processamento sensorial semelhante na NF1 aos relatados em crianças com TDAH e TEA. Ou seja, todos os três grupos apresentam dificuldades com evitação sensorial, sensibilidade, registro e busca.
Embora a magnitude das dificuldades de registro tenha sido semelhante entre os três grupos, houve graus ligeiramente diferentes de gravidade entre os grupos para sensibilidade e evitação. Essas semelhanças nos perfis sensoriais podem fornecer informações sobre mecanismos subjacentes compartilhados.
O estilo sensorial de registro, para o qual uma magnitude semelhante de dificuldades de registro é experimentada em crianças com NF1, TEA e TDAH, reflete o grau em que as crianças se orientam ou “sintonizam” os estímulos ambientais. Uma criança com baixo registro pode apresentar falta de resposta ao seu nome ser chamado ou pode não responder ou se orientar adequadamente para estímulos sociais (rostos). Em teoria, uma criança pequena que não responde abertamente a novos estímulos sensoriais e sociais perde oportunidades de aprendizagem que são fundamentais para o desenvolvimento da comunicação social e habilidades adaptativas.
Uma explicação potencial para as dificuldades de registro (ou seja, hiporresponsividade) em crianças com NF1, que também foi sugerida para crianças com TDAH e TEA, pode estar relacionada a mecanismos de atenção alterados. A orientação comportamental é uma medida da capacidade de resposta de uma criança a novas informações sensoriais e teoriza-se que seja impulsionada pela interação com redes de atenção frontoparietal dorsal “de cima para baixo” e frontoparietal ventral “de baixo para cima”.
Supõe-se que essas redes de atenção sejam diferentes em indivíduos com autismo, potencialmente levando a uma tendência reduzida de orientar e atender a estímulos sociais. A evidência de um estudo de ressonância magnética funcional (fMRI) baseado em tarefas em crianças com NF1 indica diferenças semelhantes nas redes neurais associadas à orientação para estímulos sensoriais, sugerindo que anormalidades nessas redes neurais podem levar a uma orientação atencional ineficiente ou defeituosa da informação sensorial.
A fMRI em estado de repouso também pode ser uma ferramenta valiosa no exame dessas redes neurais e como elas se relacionam com o comportamento compartilhado entre os grupos de diagnóstico. As evidências indicam que cada domínio sensorial (registro, busca, sensibilidade e evitação) está associado a um padrão distinto de conectividade funcional intrínseca do cérebro. O baixo registro, por exemplo, tem sido associado a diferenças na conectividade nas redes frontoparietal e visual em crianças com TEA e TDAH. Embora diferenças na conectividade funcional tenham sido observadas em crianças com NF1, estudos futuros que examinam as relações entre respostas sensoriais e padrões de conectividade entre grupos (NF1, TEA e TDAH) podem nos ajudar a entender a sobreposição de sintomas sensoriais – circuitos neurais e relações de sintomas de TEA e TDAH entre os diagnósticos.
Alinhados com o estudo australiano, os estudos eletrofisiológicos da atividade cerebral humana indicaram que diferenças sensoriais na NF1 provavelmente ocorrerão em vários sistemas sensoriais. Dentro da visão, potenciais evocados visuais anormais e respostas de eletroencefalografia (EEG) foram relatados, com achados sugestivos de diferenças relacionadas à NF1 nos estágios posteriores do processamento visual e amplitude aumentada de oscilações alfa apoiando déficits no processamento sensorial básico em NF1. Recentemente, Begum-Ali e colaboradores (2021) usaram EEG para medir as respostas evocadas auditivas em bebês com NF1. Em relação aos controles, os lactentes com NF1 demonstraram uma latência prolongada ao apresentar uma resposta neural diferenciada ao detectar alterações nos estímulos auditivos. Isso sugere uma resposta atípica aos estímulos auditivos muito precocemente no desenvolvimento de crianças com NF1.
Modelos laboratoriais com animais com NF1 também fornecem uma oportunidade para estudar os mecanismos celulares e moleculares subjacentes às dificuldades sensoriais nas crianças com NF1. Os dados comportamentais e fisiológicos recentes em moscas drosófilas revelaram que a perda de Nf1 em neurônios sensoriais periféricos leva a erros de processamento sensorial. É importante ressaltar que esses erros contribuem para a detecção e / ou processamento prejudicado das pistas sociais, levando a déficits sociais na mosca com NF1. Isso sugere que um fluxo interrompido de informações sensoriais pode contribuir para efeitos no comportamento na NF1.
Apoiando essa ligação entre o gene NF1 e o processamento sensorial, Dyson e colaboradores (2022) mostraram que a perda de Nf1 em mosca drosófila resultou em hipersensibilidade tátil, que foi associada a déficits de transmissão sináptica dependentes de Ras indicativos de hiperexcitabilidade neuronal. Será importante para pesquisas futuras desenvolver resultados de processamento sensorial relevantes para a tradução para a clínica, que unam estudos em humanos e animais, para ajudar a entender melhor as vias causais dessas manifestações clínicas.
Os achados deste estudo têm implicações importantes para o manejo de crianças com NF1 e para o desenvolvimento de intervenções que visem apoiar seu funcionamento global. Embora o exame de transtornos de ansiedade e humor em crianças com NF1 tenha sido relativamente negligenciado, diversos estudos relatam aumento da ansiedade e dos sintomas depressivos em comparação com os controles de DT. Embora esses sintomas sejam considerados multifatoriais na etiologia, nossos resultados sugerem uma relação entre dificuldades de processamento sensorial e ansiedade e sintomas afetivos, indicando que eles podem ocorrer de forma associada em crianças com NF1. As dificuldades de processamento sensorial podem ter um papel na compreensão da prevalência aumentada de ansiedade e sintomas afetivos relatados na NF1 e destacam a importância de apoiar uma criança que experimenta diferenças de processamento sensorial.
Houve também várias relações moderadas a fortes observadas entre os domínios sensoriais e o comportamento funcional, incluindo habilidades adaptativas e habilidades sociais no estudo atual. Esses achados apóiam a literatura que relata uma estreita associação de dificuldades de processamento sensorial com limitações funcionais na vida diária e destacam ainda mais a importância de tratarmos as dificuldades de processamento sensorial na escola e em casa.
Educadores e profissionais da saúde devem levar em consideração o processamento multissensorial ao decidir como apoiar uma criança com NF1 em todos os ambientes. Os pais de crianças com NF1 e que apresentam dificuldades de processamento sensorial devem receber informações e recursos sobre comportamentos de processamento sensorial para garantir que estratégias de apoio sejam implementadas em todos os contextos.
As intervenções de processamento sensorial geralmente envolvem a criança em estratégias projetadas para treinar novamente os sentidos, incluindo auditivo, visual, tátil, proprioceptivo, oral, olfativo, vestibular e interoceptivo (o sentido envolvido na detecção de regulação interna, como frequência cardíaca e respiração).
Ainda precisamos esclarecer as incertezas sobre o resultado das intervenções sensoriais nas crianças com NF1. A evidência da eficácia dessas intervenções em outras condições de desenvolvimento, como o TEA, ainda é um trabalho em andamento, com a evidência geral limitada devido à falta de estudos de intervenções em larga escala.
Alguns efeitos positivos, no entanto, foram publicados apoiando a Intervenção de Integração Sensorial Ayres como uma intervenção baseada em evidências para problemas sensoriais no autismo. Esta intervenção individualizada baseada em jogos lúdicos utiliza atividades sensório-motoras que abordam dificuldades específicas identificadas em uma avaliação, que estão ligadas ao funcionamento da vida. Pesquisas futuras envolvendo ensaios clínicos em larga escala dentro de uma estrutura baseada em evidências são necessárias para determinar a eficácia dessa abordagem em geral, bem como em crianças com NF1.
Este estudo, como todo estudo científico, possui limitações. Embora o relatório dos pais ofereça uma avaliação ecologicamente válida do processamento sensorial na vida diária, ele se baseia apenas nas observações dos pais, e não nas experiências subjetivas da criança. A coleta de dados de vários informantes, incluindo a criança, pode fornecer uma melhor compreensão das diferenças de processamento sensorial em crianças com NF1. Estudos futuros que combinam paradigmas de processamento sensorial direcionados à criança (por exemplo, processamento auditivo de baixo nível ou EEG) e avaliação comportamental (SP2) podem fornecer informações sobre como as anormalidades nos sistemas sensoriais podem estar relacionadas aos perfis comportamentais do processamento sensorial.
Em resumo, os resultados deste estudo indicam que crianças com NF1 têm até nove vezes mais chances de experimentar diferenças no processamento sensorial do que seus pares não afetados. Além da visão, todas as modalidades sensoriais são afetadas, e o perfil de processamento sensorial da NF1 é amplamente semelhante ao de crianças com autismo e TDAH, mostrando evitação, sensibilidade, registro e dificuldades de busca, embora em diferentes graus de gravidade.
Dificuldades de processamento sensorial em crianças com NF1 podem levar a alterações comportamentais, como mau contato visual, evitação de locais ruidosos, ansiedade e reciprocidade social prejudicada, o que pode impactar no funcionamento diário.
Os modelos experimentais de animais com NF1 também apresentam deficiências no processamento sensorial que estão ligadas a déficits sociais, o que pode nos ajudar a entender os mecanismos de hiper/hiposensibilidade sensorial.
Como os déficits sensoriais são relativamente os mais tratáveis dos mecanismos do circuito e aparecem no início do desenvolvimento da NF1, o domínio sensorial é promissor para revelar mecanismos que podem contribuir para o desenvolvimento de dificuldades comportamentais de nível superior na NF1, como comprometimento social, mas também pode fornecer uma plataforma translacional não apenas para desenvolver biomarcadores, mas também para facilitar a busca contínua por novas abordagens terapêuticas na NF1.

Uma leitora deste blog (A.M.S. de São Paulo) pergunta porque a AMANF e o CRNF decidiram não aceitar financiamento ou patrocínio de laboratórios fabricantes de medicamentos para nossas pesquisas, eventos ou divulgação.
Temos duas fortes razões para isso.
A primeira, é chamada de regra de ouro: cientistas devem ter o compromisso de buscar os fatos, mesmo que a verdade sobre determinado assunto seja contra a opinião ou o desejo de quem estuda aquela questão. Por exemplo, apesar de todo nosso desejo de encontrarmos um tratamento que diminua ou cure os neurofibromas, temos que analisar com cuidado ético e estatístico os resultados do uso de qualquer tratamento ou droga, para saber se realmente beneficiam as pessoas.
A segunda regra é a do ouro: quem financia um estudo pode modificar nosso comportamento para beneficiar seus interesses. Em outras palavras, é muito difícil para qualquer pessoa se convencer de uma ideia que pode diminuir seu lucro ou salário.
Por isso, quase sempre as indústrias de medicamentos e outras grandes empresas influenciam a maneira como são planejados e analisados os estudos científicos financiados por elas, de forma que seus resultados e conclusões beneficiem os lucros de quem está pagando os cientistas ou seus laboratórios e universidades.
Quem quiser conhecer mais sobre esta grave situação deve ler o livro “O triunfo da dúvida”, do epidemiologista David Michaels, que mostra como as BIG indústrias (tabaco, petróleo, alimentos, medicamentos, mineradoras, agronegócio, comunicação etc.) promovem o negacionismo corrompendo a ciência e a democracia e com isso garantem seus lucros sem se importar com o fato de que suas ações (no duplo sentido) nos levam para a catástrofe climática.
E observem que David Michaels ele não é nenhum anticapitalista, pois foi secretário da Agência de Segurança e Saúde Ocupacional nos governos de Barack Obama.
Por isso, cara leitora, a AMANF e o CRNF não aceitam relações comerciais com fabricantes de medicamentos, pois está bem demonstrado que a verdade sobre a eficiência de tratamentos médicos somente pode ser verificada em estudos financiados de forma independente da indústria, ou seja, com recursos públicos e transparentes.
Dr. Lor

Tive o privilégio de acompanhar a Thayanne de Carvalho Gedra nos últimos dez anos, desde os momentos de boa saúde até o agravamento recente de algumas complicações da Neurofibromatose do tipo 1.
Meu privilégio foi conhecer a pessoa Thayanne, uma jovem de bom humor e enorme disposição para viver em todos os momentos no enfrentamento da sua doença.
Antes de ontem, ela não mais resistiu e nos deixou órfãos, a sua família e todas as pessoas que conheceram a alegria que Thayanne jamais deixou de nos oferecer, mesmo quando as coisas deviam estar muito, muito difíceis para ela.
Thayanne faleceu aos 25 anos, em Curitiba, onde sua família amorosa, seu pai Reis Alberto de Carvalho Gedra e sua mãe Gislayne da Silva Santos Gedra, foram de uma dedicação incansável e incomparável, oferecendo a ela todos os recursos terapêuticos que estão disponíveis para tentar salvar a sua vida.
Em nome da AMANF, que tem contado com a participação e o apoio generoso da família em todos estes anos, e da equipe médica do CRNF, que conheceu e acompanhou passo a passo os tratamentos da Thayanne, compartilho a nossa dor e tristeza pela perda da Thayanne.
Que o exemplo de sua disposição para viver nos ajude a continuar nosso trabalho em benefício de tantas outras Thayannes e Marias e Josés, que continuam precisando de nossos cuidados.
Belo Horizonte, 16 de fevereiro de 2024
Dr. Lor

A escolha pelos melhores tratamentos para a maioria das doenças deve ser feita de forma compartilhada pela pessoa e/ou sua família e os profissionais de saúde, diante do entendimento do contexto, das necessidades e expectativas de cada pessoa e das melhores informações disponíveis a partir dos estudos científicos realizados com um número suficiente de voluntárias e voluntários sofrendo de problemas semelhantes.
Estes estudos científicos são os consensos médicos, que oferecem as orientações sobre os melhores tratamentos. Sabendo que há menos pessoas com doenças raras, menos especialistas e menos estudos científicos direcionados a estas doenças, os consensos médicos são menos robustos cientificamente nas doenças raras.
É o que acontece com as pessoas que sofrem com a Neurofibromatose do tipo 2, a NF2. Atualmente, e a NF2 passou a se chamar Schwannomatose relacionada ao gene NF2 (abreviada como NF2-SWN) e faz parte de um grupo de doenças denominadas de Schwannomatoses – ver aqui as mudanças recentes).
A NF2-SWN acontece por causa de variantes genéticas patogênicas que ocorrem em cerca de 1 em cada 25 a 33 mil pessoas (variando conforme a população estudada). O número de pessoas diagnosticadas com a NF2-SWN é ainda menor: 1 em cada 60 a 70 mil pessoas.
Para exemplificar esta raridade, nos últimos 20 anos atendemos cerca de 70 pessoas com Schwannomatoses entre mais de duas mil e duzentas famílias cadastradas no Centro de Referência em Neurofibromatoses (CRNF) do Hospital das Clínicas da Universidade Federal de Minas Gerais. Ou seja, apenas 2% da população por nós atendida.
Então, a NF2-SWN é uma doença rara e por isso a maioria dos médicos não está bem informada sobre a sua evolução. Sabemos que 95% da experiência dos neurocirurgiões é com o tratamento dos schwannomas esporádicos, ou seja, aqueles que surgem em torno dos 50 anos e apresentam comportamento diferente daqueles encontrados nas pessoas mais jovens com NF2-SWN. Quem desejar mais informações sobre o tratamento dos schwannomas esporádicos ver um consenso internacional aqui – artigo completo em inglês.
Assim, são raros os profissionais da saúde familiarizados com a NF2-SWN, o que gera incerteza sobre o melhor tratamento e por isso as pessoas e suas famílias costumam ouvir opiniões divergentes ao consultar médicos diferentes.
Diante disso, nossas sugestões de tratamentos são orientadas pelos consensos médicos internacionais baseados em experiências clínicas maiores do que a nossa. Por exemplo, o grupo de cientistas que publicou o consenso de 2012, no qual nos baseamos, reuniu dados de mais de 500 pessoas com NF2-SWN (ver aqui o texto original em inglês).
O principal problema na NF2-SWN
Nas pessoas com NF2-SWN surgem tumores nos ramos vestibulares dos nervos vestíbulo cocleares (ver na Figura 1 abaixo a localização destes nervos), chamados schwannomas (daí o nome da doença), que geralmente são bilaterais (85%), crescem lentamente e costumam ser diagnosticados a partir da segunda década de vida.
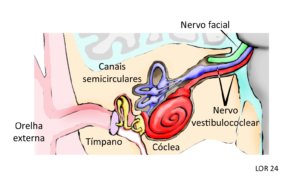
Figura 1 – Localização esquemática do nervo vestibulococlear nos ossos do crânio e sua relação com o cérebro. O ramo vestibular (em lilás) conduz para o sistema nervoso central os sinais neurais gerados nos neurônios dos canais semicirculares pelas mudanças posturais. O ramo coclear (em vermelho) conduz os sinais neurais gerados nos neurônios da cóclea pelos estímulos sonoros que chegam pela orelha externa ao tímpano e são transmitidos pelos ossículos da orelha média. Observa-se o nervo facial surgindo próximo do nervo vestibulococlear e esta proximidade é muito importante na qualidade de vida das pessoas com NF2-SWN.
Os schwannomas vestibulares podem causar perda de audição, zumbido, desequilíbrio, paralisia facial, dor de cabeça e outros problemas neurológicos, inclusive alguns potencialmente fatais.
Nas pessoas com NF2-SWN pode haver schwannomas também em outros pares de nervos cranianos e nas terminações nervosas cutâneas, outros tumores no sistema nervoso chamados meningiomas e ependimomas, além de alterações oculares. Veja em nossa página mais informações sobre o tratamento destes outros problemas.
Em 2020, a Associação de Neuro-Oncologia da Europa criou uma comissão de especialistas que publicou novo consenso sobre a NF2-SWN (ver aqui o artigo completo em inglês). No entanto, nesse consenso, apenas 15,5% dos estudos são especificamente relacionados à NF2-SWN.
O presente texto procura atualizar as orientações que estavam disponíveis em nossa página baseadas no Consenso de 2012, adicionando algumas informações mais recentes deste estudo de 2020.
REGRAS FUNDAMENTAIS
Há duas regras fundamentais no tratamento das pessoas com NF2-SWN:
Regra 1: não se faz cirurgia, nem quimioterapia e nem radioterapia num schwannoma somente porque ele foi encontrado;
Regra 2: não se faz cirurgia, nem quimioterapia e nem radioterapia num schwannoma antes de saber seus efeitos clínicos (surdez, desequilíbrio, zumbido, paralisia facial, compressão do tronco cerebral, hidrocefalia, por exemplo) e sua taxa de crescimento (ou seja, é preciso repetir a audiometria e a ressonância magnética do encéfalo em seis meses para saber a evolução clínica de cada schwannoma).
Por quê?
Não se sabe ainda ao certo o mecanismo de perda de audição nas pessoas com schwannomas vestibulares. Um estudo científico mostrou que a presença de um schwannoma vestibular esporádico produz alterações anatômicas na cóclea e redução da audição de forma independente do tamanho do tumor. Talvez o mesmo ocorra na NF2-SWN.
Em média, o maior crescimento observado é de 2,9 mm por ano e apenas metade dos schwannomas apresentam crescimento num período de 5 anos, enquanto a outra metade permanece estável.
A mesma pessoa pode apresentar crescimento em um dos tumores e nenhum crescimento no outro durante vários anos (ver exemplo abaixo).
No entanto, a exposição à radioterapia ou radio cirurgia pode ser uma causa de transformação maligna.
A compressão do tronco cerebral, por exemplo, praticamente nunca acontece como primeira manifestação da doença.
No entanto, pode haver surdez progressiva em poucas semanas em casos raros.
Para a maioria das pessoas, é melhor conviver com uma redução da audição do que com uma paralisia facial, que ocorre em cerca de 30% das cirurgias ou com o zumbido pós-operatório, que ocorre em 40% das pessoas.
Ou seja, o resultado do tratamento (por exemplo, melhorar a audição) deve ser mais provável e relevante para a pessoa com NF2-SWN do que a possível sequela do tratamento (por exemplo, a paralisia facial ou o zumbido).
Habitualmente, a cirurgia não recupera a audição já perdida, pois a maioria das pessoas é operada quando os tumores são maiores e a perda auditiva já está presente.
Em geral, as equipes de neurocirurgia pouco familiarizadas com a NF2-SWN ainda chamam os schwannomas vestibulares de “neurinoma do acústico”.
Todas as técnicas cirúrgicas disponíveis atualmente apresentam alta taxa de recorrência dos schwannomas e todos os medicamentos testados até agora ainda apresentam apenas melhora parcial dos sintomas.
Com estas informações em mente, vejamos algumas recomendações para as principais manifestações clínicas dos schwannomas vestibulares nas pessoas com NF2-SWN.
AUDIÇÃO
A redução ou perda da audição é geralmente o sintoma inicial e o mais importante para uma pessoa com NF2-SWN.
A capacidade de compreender a fala humana é a principal função da audição e por isso ela é a medida da qualidade de vida nas pessoas com NF2-SWN.
A perda auditiva geralmente ocorre lentamente, muitas vezes apenas de um lado, e cerca de 4 anos depois de diagnosticada a metade das pessoas com a NF2-SWN apresenta dificuldade importante para compreender a fala humana.
A audiometria é o principal exame complementar para a orientação clínica porque fornece uma medida objetiva da audição.

Figura 2 – Audiometria de uma pessoa com NF2-SWN. Observa-se perda auditiva em ambas as orelhas, mas maior na orelha direita. Perdas maiores do que 10 decibéis (dB) em duas ou mais frequências contíguas ou maiores do que 15 decibéis em qualquer frequência única sugerem o diagnóstico de schwannoma vestibular (com sensibilidade de 93% e especificidade menor que 70%).
A partir do resultado da audiometria, podemos classificar as perdas auditivas de acordo com o Quadro 1, uma classificação utilizada internacionalmente.

O Quadro 1 é apenas uma orientação, porque as pessoas toleram de forma diferente sua perda auditiva. Algumas se sentem muito mal no grau 2, enquanto outras suportam relativamente bem o grau 3.
Por isso, a pessoa com NF2-SWN deve escolher o momento em que a sua perda da discriminação da fala se tornou um problema tão importante que precisa ser corrigido, mesmo com os riscos de algumas sequelas.
A capacidade de discriminação da fala deve ser a informação necessária para ajudarmos a pessoa com NF2-SWN a decidir se deseja ou não receber a intervenção cirúrgica ou medicamentosa.
Para isso, devemos indicar as audiometrias seriadas (a cada seis meses, se não houver novos sintomas antes).
A progressão rápida da perda auditiva (de um grau ou mais em seis meses, por exemplo) é um dos critérios que devem ser levados em conta para a decisão ou não de tratar (ver abaixo um exemplo verdadeiro em nossa experiência).
Esta perda auditiva progressiva e relevante para a pessoa com NF2-SWN combinada com o tamanho do tumor é que orientam nossas sugestões terapêuticas.
Zumbido
Em algumas pessoas o zumbido pode ser o primeiro sintoma, acompanhado ou não da perda auditiva. Dependendo da progressão da perda, nos primeiros momentos o incômodo pode ser leve, a pessoa não perceber e continuar sentindo o zumbido, achando que uma hora vai passar, sem relacionar com uma possível doença.
É importante que o zumbido não seja banalizado, pois ele pode ser um indicativo de perda auditiva. Há pessoas que não desenvolvem o zumbido, mas noutras ele pode ser o sinal mais importante (11%).
TAMANHO DO TUMOR
Sabendo que não existe maneira de conhecer o comportamento futuro de um schwannoma que acaba de ser diagnosticado, o método de escolha para avaliar o tamanho dos schwannomas vestibulares é a ressonância magnética (RNM) seriada a cada 6 ou 12 meses (ou antes, se surgirem novos sintomas neurológicos).
Com o resultado da RNM podemos classificar o tamanho do schwannoma segundo a Figura 2.
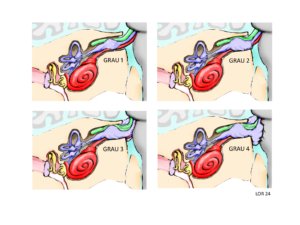
Figura 3 – Escala de Koos para schwannomas vestibulares nas pessoas com NF2-SWN. Grau 1 – Tumor pequeno, restrito ao canal auricular interno. Grau 2 – Tumor médio, avançando para dentro do ângulo bulbopontino, mas sem contato com o tronco cerebral. Grau 3 – Tumor grande, ocupando a cisterna bulbopontina, mas sem contato com o tronco cerebral. Grau 4 – Tumor muito grande com deslocamento de nervos e compressão do tronco cerebral. Observa-se a progressiva compressão do nervo facial com o crescimento do schwannoma.
Esta classificação nos ajuda a compreender algumas situações:
QUAIS SÃO OS TRATAMENTOS POSSÍVEIS?
A ideia principal no tratamento dos problemas causados pela NF2-SWN é que estamos diante de uma doença:
Assim, precisamos pensar nos cuidados médicos no longo prazo, procurando antecipar as possíveis complicações e limitações.
A associação The Children’s Tumor Foundation publicou uma cartilha (ver aqui – em inglês) com orientações importantes para as pessoas com NF2-SWN, que adaptamos para a população brasileira abaixo.
Coordenação clínica
O primeiro passo para o tratamento, depois do diagnóstico confirmado de NF2-SWN (ver aqui), é a escolha de um (a) médica (o) com experiência em neurofibromatoses para coordenar a observação ativa (ver abaixo), as reavaliações, intercorrências, exames e especialistas que podem ser necessários ao longo da vida.
Grupos de ajuda
A participação em grupos de pessoas com neurofibromatoses pode ser fonte de informação e conforto psicológico. Participe da Associação Mineira de Apoio aos Portadores de Neurofibromatoses (AMANF – clique aqui) ou de outras associações semelhantes que existem em vários países.
Aconselhamento genético
É sempre importante realizar o painel genético para identificar o diagnóstico preciso da Schwannomatose (ver aqui).
Sabendo que a NF2-SWN é hereditária (30 a 50% de chance de transmissão da variante patogênica a descendentes), é fundamental ajudar as pessoas no controle de natalidade e planejamento familiar, incluindo a discussão sobre a fertilização in vitro com seleção de embriões.
O diagnóstico da NF2-SWN numa pessoa que já possui filhas ou filhos traz uma questão delicada sobre se deve ou não ser investigada a transmissão da variante para descendentes e quando seria o momento adequado para fazer esta investigação. Geneticistas estão habilitadas (os) a orientar eticamente estas decisões.
A sugestão do Children´s Tumor Foundation é de que crianças com possibilidade de terem herdado uma variante patogênica da NF2-SWN devem realizar:
Por enquanto, o SUS ainda não oferece nem o exame genético e nem a fertilização in vitro, o que tem sido uma pauta entre as lutas de associações de pacientes, como da AMANF.
Oftalmologia
A possibilidade de opacificação do cristalino nas pessoas com NF2-SWN (chamada catarata juvenil ou catarata subcapsular posterior) exige que a capacidade visual seja regularmente avaliada por oftalmologista experiente em neurofibromatoses (ver mais informações aqui).
Fonoterapia
A terapia fonoaudiológica pode ajudar na convivência com a baixa audição e com o zumbido. Além disso, pode orientar na aquisição da linguagem labial e na linguagem de sinais, que devem ser aprendidas enquanto há audição.
Além disso, a fonoaudiologia pode ajudar na adaptação de atividades da vida diária, como a vida social, uso de telefones e televisão.
Apoio psicológico
Os impactos psicológicos da NF2-SWN são profundos e a pessoa acometida assim como sua família geralmente necessitam de apoio especializado para conseguir superar as limitações e levarem uma vida com boa qualidade.
Fisioterapia
Fisioterapeutas podem auxiliar na recuperação da paralisia facial e tratamento do desequilíbrio e perda de força que eventualmente venham a ocorrer.
Observação ativa
Significa reavaliar periodicamente os sintomas clínicos, em especial a função auditiva e a visão (risco de catarata) e o tamanho dos schwannomas. Esta parece ser a melhor conduta para a maioria das pessoas com NF2-SWN. A observação ativa pode variar de alguns anos a poucos meses sem qualquer tratamento cirúrgico ou quimioterápico.
Var abaixo o fluxograma da observação ativa e outras condutas, considerando a perda auditiva e o tamanho do schwannoma. Adaptamos o resumo das recomendações do Consenso de 2012 e de 2020 na Figura 3 abaixo.
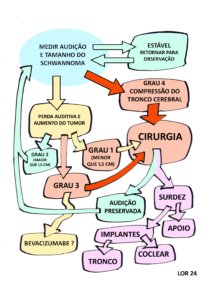
Figura 3 – Fluxograma da observação ativa e outras condutas para os schwannomas vestibulares nas pessoas com NF2-SWN. Adaptado dos Consensos de 2012 e 2020. Observação: Nos manuais de cirurgia recomenda-se cirurgia em um dos tumores bilaterais no Grau 1 com a intenção de preservar a audição, mas não conseguimos dados mostrando este desfecho favorável.
Ressecção cirúrgica
A cirurgia (ressecção parcial ou total) de um schwannoma deve ser sugerida à pessoa com NF2-SWN e sua família quando:
Radio cirurgia e radioterapia
São ambos tratamentos contraindicados nas pessoas com NF2-SWN por risco de transformação maligna. No entanto, esta técnica tem sido indicada nas pessoas com schwannomas esporádicos (sem NF2-SWN) menores do que 3 cm. As condições e habilitação da equipe cirúrgica podem entrar no cálculo dos riscos e benefícios.
Medicamentos
Até o presente momento, apenas o medicamento bevacizumabe tem se mostrado útil em casos selecionados de schwannomas vestibulares em pessoas com NF2-SWN (ver aqui comentário detalhado sobre este medicamento).
Aparelhos auditivos
Comuns
Os aparelhos auditivos comuns (usados nas pessoas idosas, por exemplo), que apenas aumentam a intensidade do estímulo sonoro em determinadas frequências, não funcionam adequadamente nas pessoas com NF2-SWN.
Implantes
Quando os tumores ou o resultado das cirurgias resultaram em surdez completa, aparelhos auditivos especiais podem ser implantados na cóclea (se houver nervo coclear funcional) ou no tronco cerebral. Estas possibilidades podem ser compreendidas e discutidas com especialistas a partir desta revisão científica de 2016: “Restauração da audição em pacientes com NF2” (ver aqui artigo completo em inglês).
Dúvidas e sugestões
Estas informações podem ser melhoradas com sua ajuda.
Envie-nos suas dúvidas, sugestões e críticas para rodrigues.loc@gmail.com
Assinam este texto:
Profa. Dra. Juliana Ferreira de Souza
Professora do Departamento de Pediatria da Faculdade de Medicina da Universidade Federal de Minas Gerais – Coordenadora do Centro de Referência em Neurofibromatoses do Hospital das Clínicas da UFMG
Dra. Luíza Cançado Guerra D’Assumpção
Neurocirurgiã com Mestrado e Doutoranda em Neurocirurgia na Universidade Federal de Minas Gerais
Prof. Dr. Luiz Oswaldo Carneiro Rodrigues
Professor Aposentado da UFMG e Diretor Administrativo da Associação Mineira de Apoio aos Portadores de Neurofibromatose (AMANF)
Belo Horizonte, janeiro de 2024
Agradecemos as leituras e as ótimas sugestões de: Ramon Cosenza, Thalma de Oliveira Rodrigues, Fabíola A.A. Rocha Bastos, Érica Onofre e Aline da Silva Freitas.
[1] Importante ressaltar que a abordagem cirúrgica deve acontecer com monitoramento tanto nos schwannomas nos pares cranianos que possam ser afetados pela cirurgia quanto na coluna, permitindo à equipe decidir a melhor abordagem, se deve remover todo o tumor ou manter parte dele para preservar os nervos ao redor.

Saber QUANDO procurar especialistas é uma das questões importantes no acompanhamento das pessoas com neurofibromatoses.
Na maioria das vezes, a primeira consulta com especialistas em NF1 pode identificar os achados, as manifestações e as complicações da NF1 e classificar a gravidade da doença (ver aqui mais informações sobre isto).
NF1 com gravidades mínima e leve
Assim, na maioria dos casos, as pessoas com gravidade mínima ou leve devem levar uma vida normal, sem quaisquer restrições de atividades físicas ou alimentares.
As pessoas com gravidade mínima ou leve devem levar consigo um laudo da primeira consulta com especialista em NF1 e podem ser acompanhadas APENAS pela equipe multidisciplinar da Atenção Primária à Saúde (APS), junto ao médico(a) de família e comunidade (MFC) (pessoas de todas as idades), pediatra (crianças e adolescentes) ou clínica médica (pessoas adultas).
Especialistas em NF devem emitir laudos para orientar a equipe da APS e os profissionais médicos (MFC, pediatria e clínica médica) sobre os problemas que devem ser acompanhados nas crianças e adolescentes (geralmente dificuldades de aprendizado, acuidade visual, pressão arterial, alinhamento da coluna e puberdade) ou nos adultos (geralmente pressão arterial, aconselhamento genético, neurofibromas cutâneos).
Quando surgir um sintoma novo ou no caso de alguma dúvida é o momento de ouvir a pessoa especializada em NF1.
De um modo geral, exceto nas situações de urgência, é claro, sugerimos aos profissionais da APS que ouçam a médica ou médico especialista em NF1, antes de serem indicados novos exames (ressonâncias, biópsias etc.) ou consultas com outros especialistas (cirurgia, neurologia, dermatologia etc.).
NF1 com gravidade moderada
Na primeira consulta, especialistas em NF1 podem identificar algumas complicações da NF1 que classificam a gravidade da doença como moderada.
Nestes casos, a pessoa com NF1 também deve retornar aos cuidados gerais da equipe multidisciplinar da APS, junto ao médico ou médica de família e comunidade (pessoas de todas as idades), pediatra (crianças e adolescentes) ou clínica médica (pessoas adultas), com o laudo detalhado e com reavaliações periódicas com especialista em NF1.
A situação ideal para os casos de gravidade moderada é aquela em que a APS coordena os cuidados gerais em parceria com a pessoa especialista em NF1 e com outras especialidades como a cirurgia, oftalmologia, neurologia etc.
Casos graves de NF1
Mais uma vez, acreditamos no papel de coordenação do cuidado do profissional médico da APS (MFC, pediatria ou clínica médica) na condução médica dos principais problemas existentes.
É preciso alguém com a visão de conjunto dos diversos e complexos problemas de saúde que acometem as pessoas com NF1 e maior gravidade.
Geralmente, os casos mais graves necessitam de consultas mais frequentes com especialistas em NF1.
Schwannomatoses
As Schwannomatoses (SCH) são mais raras do que a NF1 e geralmente se manifestam a partir da segunda década de vida.
Nas primeiras consultas com especialistas em NF, deve ser confirmado o diagnóstico do tipo de SCH (ver aqui mais informações sobre isto) e laudos devem ser entregues para ajudar a equipe da APS, no acompanhamento dos problemas gerais de saúde e daqueles agravados pelas SCH.
No entanto, as características neurológicas dos problemas clínicos nas SCH (baixa audição, dor, convulsões etc.) exigem a participação mais frequente da neurologia, neurocirurgia, fonoaudiologia, clínica de dor etc., além de especialistas em NF.
Conclusão
Apesar das NF serem doenças genéticas raras, a equipe multidisciplinar da APS, junto aos profissionais médicos da MFC, pediatria e clínica médica, devem coordenar o cuidado das pessoas com NF1 ou SCH e especialistas em NF devem seguir como consultores para o apoio permanente depois das primeiras consultas.
Dra. Juliana Ferreira de Souza
(Professora do Departamento de Pediatria, Coordenadora do Centro de Referência em Neurofibromatoses, Faculdade de Medicina da Universidade Federal de Minas Gerais)
Dr. Luiz Oswaldo Carneiro Rodrigues
Médico, Professor Aposentado da UFMG, Diretor Administrativo da AMANF.

ATENÇÃO
Solicito às pessoas interessadas em se consultar comigo por videoconferência
(por causa da pandemia de COVID-19)
que enviem um e-mail para agendar:
Respostas a dúvidas também somente serão respondidas por e-mail.
Lamento, mas tenho recebido muitas mensagens por WhatsApp, o que tem me confundido nas respostas.
Por isso, somente urgências podem ser comunicadas por WhatsApp.
Atenciosamente,
Dr Lor
